Metalliska biomaterial

Innehållsförteckning
Jämfört med keramik eller polymerer, spelar metaller en helt annan roll inom biomedicinsk teknik. De utmärker sig främst genom sina utmärkta mekaniska egenskaper och höga elektriska och termiska ledningsförmåga. Detta beror på metallbindningens natur – vissa av elektronerna är delokaliserade och bildar ett moln av ”fria elektroner” som ansvarar för konduktiviteten och för den starka, om än icke-riktade, bindningen mellan metalljoner. Denna struktur gör det möjligt för atomerna i kristallgitteret att röra sig i förhållande till varandra utan att störa ordningen, vilket resulterar i den plasticitet som är karakteristisk för metaller och förmågan att genomgå stora deformationer utan plötslig förstörelse.
Denna egenskap utnyttjas mycket medvetet i biomaterial. Metaller fungerar både som passiva substitut för hård vävnad – i höft- och knäproteser, benplattor, skruvar, intramedullära spikar, tandimplantat – och som material för mer ”aktiva” anordningar såsom vaskulära stentar, katetrar, ortodontiska trådar och cochleära implantat. I dessa tillämpningar är det inte bara styrkan som räknas, utan också formbarhet, elasticitet, ledningsförmåga och lämplighet för precisions tillverkning.
Historien om metalliska biomaterial började med stållegeringar. Den första legeringen som utvecklades specifikt för ortopediska tillämpningar var vanadinstål, som användes för att tillverka plattor och skruvar för fixering av frakturer (kända som Sherman-plattor). Med tiden ersattes det av rostfritt stål och senare av kobolt- och kromlegeringar samt titanlegeringar. Dessa legeringar använder ett antal metaller – järn (Fe), krom (Cr), kobolt (Co), nickel (Ni), titan (Ti), tantal (Ta), niob (Nb), molybden (Mo) och volfram (W) – som i större doser är giftiga för kroppen, men i form av stabila, korrosionsbeständiga legeringar tolereras väl.
Den största utmaningen vid användning av metaller är korrosion i in vivo-miljön. Korrosionsprodukter kan leda till både försvagning av implantatet i sig och negativa biologiska reaktioner, som lokal inflammation, vävnadsmissfärgning, organskador eller immunreaktioner. Därför fokuserar modern teknik för metalliska biomaterial på legeringar som kan bilda hållbara, passiva skyddande skikt på ytan och på medveten ytmodifiering för att kombinera god hållfasthet, hög korrosionsbeständighet och en lämplig biologisk reaktion.
Rostfritt stål som implantatmaterial
Rostfritt stål var ett av de första materialen som framgångsrikt ersatte vanadinstål i implantat. Inledningsvis användes 18–8-stål (typ 302), som innehåller cirka 18 % krom och 8 % nickel, med betydligt bättre korrosionsbeständighet än klassiska kolstål. Med tiden uppstod en variant av 18–8 med tillsats av molybden (18-8sMo), idag känt som 316-stål, följt av en modifiering med reducerat kolinnehåll – 316L-stål. Genom att minska kolhalten från cirka 0,08 % till maximalt 0,03 % minskar tendensen för att kromkarbider ska bildas vid korngränserna, vilket förbättrar korrosionsbeständigheten i kloridrika miljöer som är fallet med kroppsvätskor.
Krom är huvudsakligen ansvarigt för korrosionsbeständigheten hos rostfria stål. Även med en Cr-halt på 11 % bildas ett tunt skyddande oxidskikt på ytan, vilket ger stålet ett så kallat passivt tillstånd. Tillsatsen av molybden ökar motståndskraften mot punktkorrosion i kloridmiljöer, vilket gör 316/316L-stål mer lämpligt för fysiologiska förhållanden. Nickel stabiliserar i sin tur den austenitiska fasen (γ, fcc-struktur) vid rumstemperatur, vilket gör materialet icke-magnetiskt och förbättrar dess korrosionsbeständighet.
Austenitiska stål kan inte härdas genom konventionell värmebehandling, men de reagerar mycket bra på kallbearbetning. Detta gör det möjligt att justera ett brett spektrum av mekaniska egenskaper – från mer duktila, mjuka strukturer till betydligt härdade strukturer med hög draghållfasthet. Mekaniska data för 316L-stål visar att olika kombinationer av hållfasthet och duktilitet kan uppnås beroende på graden av kallformning, vilket är viktigt för att anpassa materialet till implantatets specifika funktion.
Trots sina många fördelar är stål av typerna 316 och 316L inte idealiska material. Under höga belastningsförhållanden, särskilt i områden med begränsad syretillgång, såsom runt skruvgängor eller benplattanslutningar, kan sprick- och punktkorrosion uppstå, och på lång sikt kan även utmattningskorrosion uppstå. Av denna anledning används rostfria stål oftast i tillfälliga implantat såsom plattor, skruvar, spikar och fixeringstrådar, som kan avlägsnas när benet har läkt. För att förbättra deras egenskaper används ytmodifieringar i stor utsträckning – från polering och passivering i salpetersyra till anodisering eller kväveimplantation genom glödurladdning, vilket ökar motståndskraften mot korrosion, slitage och utmattning.
Kobolt- och kromlegeringar
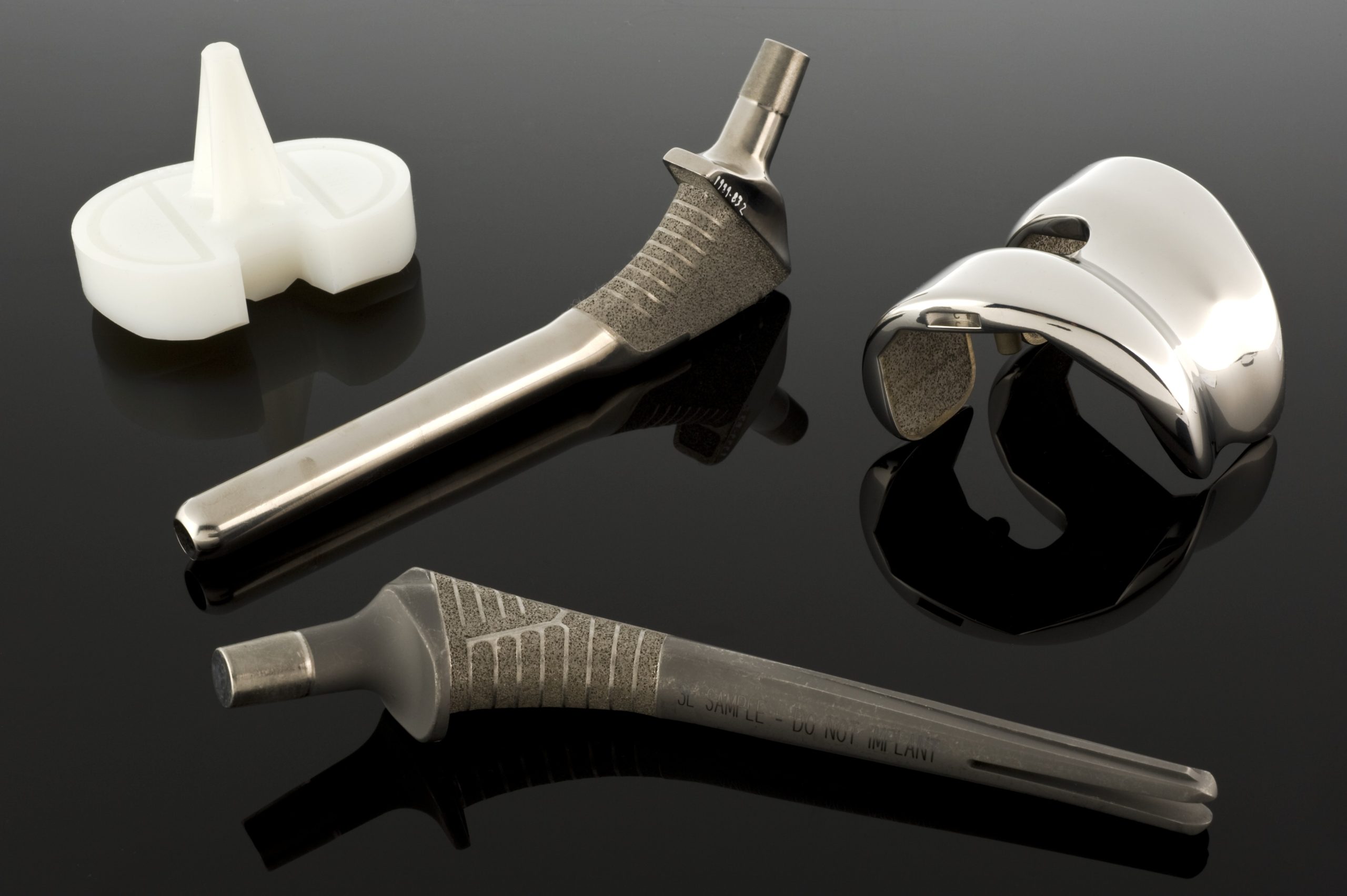
När de mekaniska kraven överstiger rostfria stålens kapacitet kommer kobolt- och kromlegeringar in i bilden. Det finns två huvudgrupper av sådana legeringar i biomaterial: gjuten CoCrMo-legering, som bland annat används i endoproteskoppar och -huvuden, och smidd CoNiCrMo-legering, som används i komponenter som utsätts för hög belastning, såsom höft- eller knäprotesstammar. ASTM-standarderna beskriver flera versioner av sådana material (F75, F90, F562, F563), men i klinisk praxis dominerar CoCrMo och CoNiCrMo.
Kobolt och krom bildar en fast lösning upp till cirka 65 % Co, och tillsatsen av molybden medför kornförfining och därmed ökad hållfasthet efter gjutning eller smidning. Krom har en dubbel roll: det ökar korrosionsbeständigheten genom att bilda ett passivt oxidskikt och bidrar till lösningshärdningen. I klinisk praxis kännetecknas Co–Cr-legeringar av en mycket hög elasticitetsmodul – i intervallet 220–234 GPa, högre än rostfritt stål, och mycket god slitstyrka.
Denna höga styvhet har däremot sina konsekvenser. Ett implantat som är för styvt kan ta på sig för stor belastning, vilket leder till stressavskärmning – en minskning av belastningen på patientens eget ben och dess gradvisa resorption. Även om den kliniska betydelsen av denna effekt inte är helt klar, är den en viktig faktor vid utformningen och formen av protesstammar. Å andra sidan gör hårdhet och nötningsbeständighet kobolt- och kromlegeringar till ett utmärkt val för ”metall-metall”-friktionspar, där det är avgörande att minimera långsiktigt slitage. Studier av långvariga endoproteser med sådana par visar på en mycket låg linjär slitagehastighet, i storleksordningen några mikrometer per år.
En annan viktig fråga är frisättningen av joner från Co-Cr-legeringar och deras potentiella toxicitet. Experiment i Ringers lösning har visat att hastigheten för nickelutsläpp från CoNiCrMo-legering och 316L-stål är mycket likartad efter en viss tid, även om koboltlegeringen innehåller ungefär tre gånger mer nickel. In vitro-studier har visat att koboltpartiklar kan vara toxiska för benbyggande celler, medan krom- och Co-Cr-legeringspartiklar tolereras mycket bättre. Höga koncentrationer av Co- och Ni-jon-extrakt stör tydligt cellmetabolismen i odlingar, medan kromjoner uppvisar lägre toxicitet.
Titan och dess legeringar
Bland de metaller som används som biomaterial intar titan en särställning. I den elektrokemiska serien är det ett ”aktivt” element, men i en fysiologisk miljö är det täckt av ett mycket stabilt, passivt oxidskikt, tack vare vilket dess korrosionsström i fysiologiska lösningar är extremt låg, i storleksordningen 10⁻⁸ A/cm². I praktiken förblir titanimplantat visuellt oförändrade efter en lång tid i kroppen.
Ren titan (cp-Ti) och den mest populära legeringen Ti–6Al–4V kombinerar mycket god korrosionsbeständighet med ett fördelaktigt förhållande mellan styrka och vikt. Deras elasticitetsmodul är lägre än stål eller Co–Cr-legeringar, vilket gör att de liknar ben och potentiellt minskar risken för stressavskärmning. Å andra sidan är titan inte lika styvt eller starkt i drag som de bästa stål- eller koboltlegeringarna, så konstruktionen av bärande element kräver noggrann spänningsanalys och ofta ett större tvärsnitt.
Under de senaste decennierna har även titanlegeringar med reducerad elasticitetsmodul och ökad korrosionsbeständighet utvecklats, som bland annat innehåller Nb och Zr, till exempel Ti–13Nb–13Zr, särskilt utformade för ledproteser. Dessutom har ythärdning av Ti-legeringar (till exempel termokemisk behandling, nitrering) utvecklats, vilket gör det möjligt att kombinera god biokompatibilitet hos substratet med hög slitstyrka i friktionszoner.
Nickel-titanlegeringar (NiTi), som uppvisar formminne och superelasticitet, utgör en speciell grupp. Tack vare martensitisk omvandling kan de återge en tidigare registrerad form när de värms upp över omvandlingstemperaturen eller uppvisa mycket hög elastisk deformabilitet i ett smalt spänningsintervall. Denna egenskap används bland annat i vaskulära stentar, ortodontiska bågar och kateterledare, vilket möjliggör atraumatisk insättning av enheter och deras stabila expansion efter dilatation.
När det gäller titan är ytegenskaperna särskilt viktiga. Studier visar att både grovhet och ytkemi reglerar osteoblasternas och de benbildande cellernas beteende – de påverkar vidhäftning, proliferation och produktionen av tillväxtfaktorer och cytokiner. Lämplig kemisk behandling av ytan på Ti och dess legeringar kan göra dem bioaktiva, det vill säga. kapabla att bilda ett apatitskikt i kontakt med kroppsvätskor, vilket främjar direkt bindning med ben.

Metaller inom tandvården och andra specialtillämpningar
Både ädelmetaller och basmetaller används inom tandvården. Guld är praktiskt taget korrosionsbeständigt (immunitetstyp) och ger utmärkt hållbarhet och kemisk stabilitet vid protetiska rekonstruktioner. Dess begränsningar är dock hög densitet, otillräcklig hållfasthet för tunga belastningar samt kostnad, vilket innebär att det praktiskt taget inte används inom ortopedi.
Tandamalgam, en legering av silver, tenn och kvicksilver, används ofta. Även om de enskilda faserna i detta material är passiva vid neutralt pH, korroderar amalgam i praktiken ofta, särskilt i närvaro av luftningsskillnader under bakterieplack och lokala galvaniska mikroceller. Det är faktiskt det mest korrosionsbenägna materialet som används inom tandvården, vilket yttrar sig i missfärgning och bildning av korrosionsprodukter på fyllningarnas yta.
Gruppen av specialmetaller omfattar även platinametaller och deras legeringar, som används där kemisk beständighet och ledningsförmåga är avgörande, samt Ni-Cu-legeringar och andra system som används vid hypertermi – avsiktlig uppvärmning av cancervävnad med hjälp av ett inducerat magnetfält. Dessa typer av legeringar är utformade så att deras termiska respons i ett elektromagnetiskt fält kan kontrolleras väl, vilket möjliggör precis leverans av värmeenergi till tumören.
Korrosion av metallimplantat i en biologisk miljö
Korrosion är ett centralt fenomen för metalliska biomaterial. I kroppen har vi att göra med en elektrolytvätska som innehåller joner (Na⁺, Cl⁻, HCO₃⁻, fosfater), varierande pH-värde och potentialskillnader mellan olika områden – alla dessa faktorer gynnar elektrokemiska reaktioner.
Pourbaix-diagram, som visar förhållandet mellan elektrokemisk potential och pH, används för att beskriva metallers stabilitet. De skiljer mellan områden med korrosion (aktivitet), passivitet och immunitet. I människokroppen har olika vätskor olika pH-värden och syresättningsnivåer: vävnadsvätska har vanligtvis ett pH-värde på cirka 7,4, men i närheten av ett sår kan det sjunka till så lågt som 3,5, och i ett infekterat sår kan det stiga till 9,0. Detta innebär att en metall som fungerar bra i ett område av kroppen kan korrodera i ett annat.
Pourbaix-diagram har dock sina begränsningar – de baseras på jämviktslägen i ett enkelt system med metall, vatten och reaktionsprodukter. Förekomsten av kloridjoner eller komplexa organiska molekyler kan avsevärt förändra metallens beteende, och den förutsagda passiviteten kan i praktiken visa sig vara alltför optimistisk. Därför används polariseringskurvor utöver dessa diagram, vilket gör det möjligt att bestämma korrosionsströmmen och på denna grund beräkna antalet joner som frigörs i vävnaderna och hastigheten för materialförlust. Alternativt mäts förlusten av provmassa under exponering i en lösning som liknar kroppsvätska.
Korrosion av implantatmaterial kan ta olika former. Jämn korrosion leder till relativt homogen materialförlust, men lokaliserade former är mycket farligare. Gropkorrosion orsakar djupa, lokaliserade förluster – rostfritt stål är särskilt känsligt för detta i närvaro av klorider. Sprickkorrosion uppstår i områden med begränsad tillgång till syre, såsom mellanrummen mellan skruven och plattan, där de lokala kemiska förhållandena (pH, jonkoncentration) skiljer sig avsevärt från den omgivande miljön. Nötningskorrosion är korrosion som är förknippad med mikroförflyttningar mellan två kontaktytor – mekanisk nötning förstör det passiva skiktet, exponerar ny metall och påskyndar korrosionen.
Spänningskorrosion och utmattningskorrosion är speciella former av korrosion. Vid mekanisk belastning, särskilt repetitiv belastning, kan korrosionshastigheten öka och mikrosprickor sprida sig snabbare. I implantat av rostfritt stål har man till exempel observerat frakturer på höftspikar och -stift där böjbelastningar och en aggressiv fysiologisk miljö förekom samtidigt. I sådana fall är det svårt att tala om ”ren” korrosion – det är alltid en dynamisk interaktion mellan kemi, mekanik och mikrostruktur.
Olika metaller beter sig olika i detta avseende. Ädelmetaller, såsom guld, är praktiskt taget korrosionsbeständiga – deras elektrokemiska standardpotential är positiv och i Pourbaix-diagrammen upptar de immunitetsområdet. Titan och Co–Cr-legeringar baseras på passivitet – de bildar ett väl vidhäftande, tätt oxidskikt, tack vare vilket deras korrosionsströmmar är mycket låga och ytan förblir stabil. Rostfria stål drar också nytta av kromets passivitet, men deras passiva skikt är mindre stabilt, vilket gör dem mer känsliga för grop- och sprickkorrosion. Tandamalgam, å andra sidan, är visserligen termodynamiskt sett delvis passivt, men i praktiken ett material som är mycket känsligt för korrosion, särskilt i närvaro av biofilm.
Tillverkning och bearbetning av metallimplantat
Tillverkningen av metallimplantat handlar inte bara om att forma geometrin, utan också om att kontrollera mikrostrukturen och ytans skick, som avgör utmattningshållfasthet, korrosionsbeständighet och biologisk respons.
När det gäller rostfria stål är det avgörande att austenitiska stål härdas mycket snabbt under kompression. Detta innebär att deras hållfasthet ökar under kallbearbetning (valsning, dragning, bockning), men samtidigt minskar deras plasticitet. För att återställa den erforderliga deformabiliteten används mellanliggande glödgning, varvid temperaturer och tider som främjar utfällning av kromkarbider vid korngränserna, vilket försvagar korrosionsbeständigheten, måste undvikas. Efter formningen rengörs komponenterna, avoxideras (kemiskt eller abrasivt) och passiveras, vanligtvis i en salpetersyralösning i enlighet med ASTM F86.
Co-Cr-legeringar beter sig annorlunda – de är mycket känsliga för förstärkning under deformation, vilket i många fall gör konventionellt smide svårt. Därför tillverkas komponenter med komplexa geometrier, såsom proteshuvuden och protesskålar, ofta med hjälp av precisionsgjutning (den så kallade förlorade vaxmetoden). Processen innebär att man förbereder ett exakt vaxmönster, täcker det med eldfast material, bränner ut vaxet och häller flytande Co-CrMo-legering i formen vid hög temperatur. Formens temperatur och kylningstid påverkar kornstorleken samt storleken och fördelningen av karbider – en fin mikrostruktur ökar hållfastheten men kan minska motståndskraften mot spröda brott, medan större korn och karbider förbättrar duktiliteten på bekostnad av hållfastheten. Konstruktören måste därför hitta en kompromiss mellan hållfasthet och brottmotstånd.
För titanlegeringar är gjutning, smide och värmebehandling samt ytbehandling avgörande. Titan kräver en skyddande atmosfär under högtemperaturbearbetning eftersom det lätt reagerar med syre och kväve och bildar spröda ytskikt. Efter den inledande mekaniska bearbetningen sandblästras, syraetsas, anodiseras eller kombineras titanimplantatens ytor, vilket resulterar i en gynnsam mikrometerruffhet och ett modifierat oxidskikt. Studier visar att ytor som prepareras på detta sätt främjar snabbare beninväxning och bildandet av en stark mekanisk och, potentiellt, kemisk bindning.
Tillverkningsprocesserna för formminneslegeringar utgör en separat kategori. I deras fall är det avgörande med en exakt kontroll av den kemiska sammansättningen och värmebehandlingen, som avgör martensitiska omvandlingstemperaturer och superelasticitetsområdet. NiTi-stentar eller ortodontiska bågar måste uppnå önskad deformation och återgå till sin form inom ett strikt definierat temperaturområde, inklusive fysiologiska förhållanden.
Sammanfattning – Metalliska biomaterial
Metalliska biomaterial utgör en omfattande familj, där varje material har sin egen, ganska exakt definierade funktionella nisch. Rostfritt stål, särskilt typ 316L, är relativt billigt och lättbearbetat material med goda mekaniska egenskaper och tillräcklig korrosionsbeständighet, vilket är anledningen till att det främst används i tillfälliga implantat och mindre kritiska komponenter. Co-Cr-legeringar erbjuder mycket hög hållfasthet, hårdhet och slitstyrka, vilket gör dem till det självklara valet för proteskoppar och -huvuden samt för stammar, där hållbarhet under tunga belastningar är viktigt. Titan och dess legeringar, som kombinerar mycket god korrosionsbeständighet, gynnsam elasticitetsmodul och hög biokompatibilitet, har blivit ”guldstandarden” för långvariga implantat, särskilt inom ortopedi och tandimplantologi.
Speciallegeringar, såsom formminneslegeringen NiTi, spelar också en viktig roll och möjliggör helt nya behandlingsstrategier – från självexpanderande stentar till superelastiska ortodontiska bågar. Guld och amalgam är fortfarande viktiga inom tandvården, även om deras användningsområden håller på att ses över med hänsyn till estetiska och säkerhetsmässiga krav.
Den gemensamma nämnaren för alla metalliska biomaterial är behovet av att kontrollera korrosion och vävnadsinteraktion. Pourbaix-diagram, polariseringskurvor, utmattningstester och jontoxicitetsstudier utgör grunden för den tekniska utformningen av dessa material. Ytteknik är lika viktigt – det avgör kvaliteten på det passiva skiktet, slitstyrkan, cellvidhäftningen och typen av bindning med benet.
Som ett resultat av detta betraktar modern biomaterialteknik inte metaller isolerat, utan behandlar dem som en del av komplexa system: en metallkärna kan beläggas med bioaktiva keramer, omges av en polymerkomposit eller fungera tillsammans med porösa keramiska strukturer som stödjer regenerering. Metaller ger bärförmåga och plasticitet, keramik ger bioaktivitet och nötningsbeständighet, och polymerer ger flexibilitet och förmåga att bilda mjuka strukturer. Tillsammans utgör de grunden för modern implantologi, där målet inte längre bara är att ”ersätta delar”, utan att uppnå funktionell, biologiskt integrerad organrekonstruktion.