Phasengleichgewichtssysteme von Legierungen
Inhaltsverzeichnis
Bei reinen Metallen sind Phasenumwandlungen meist klar umrissen. Schmelzen und Erstarren finden an einer exakt definierten Temperatur statt; auch manche Strukturumwandlungen im festen Zustand laufen punktförmig ab. In Kühl- und Heizkurven zeigt sich das als charakteristische Temperaturplateaus: Die zu- oder abgeführte Energie wird zunächst für die Umwandlung verbraucht, nicht für eine weitere Temperaturänderung.
Legierungen verhalten sich deutlich weniger „punktgenau“. Häufig beginnt die Erstarrung bei einer Temperatur und endet erst bei einer niedrigeren. Dazwischen koexistieren Phasen, die sich nicht nur in ihrem Aggregatzustand unterscheiden, sondern auch in ihrer Zusammensetzung. Während die Temperatur fällt, verschiebt sich das chemische Gleichgewicht fortlaufend. Genau deshalb erstrecken sich viele Umwandlungen über Temperaturbereiche, statt in einem einzigen, scharf abgrenzbaren Moment zu passieren.
Um dieses Verhalten systematisch zu beschreiben, nutzt die Werkstoffkunde Phasengleichgewichtsdiagramme, kurz Phasendiagramme. Man kann sie wie eine Landkarte lesen: Sie zeigen, welche Phasen bei gegebener Temperatur und Zusammensetzung stabil sind und welche Umwandlungswege beim Erhitzen oder Abkühlen typischerweise eingeschlagen werden. Damit lassen sich Kristallisationsabläufe, Festkörperumwandlungen und letztlich Mikrostruktur sowie Eigenschaften einer Legierung vorausschauend einordnen.
Key concepts: system, phase, and components
Wer Phasendiagramme sicher lesen will, muss ihre Begriffe präzise verstehen. Ein System ist in thermodynamischem Sinne ein abgegrenzter Ausschnitt der Realität, der unter definierten Bedingungen betrachtet wird, etwa eine Legierungsprobe, die kontrolliert abgekühlt wird.
Eine Phase ist ein homogener Teil dieses Systems. Sie besitzt innerhalb ihrer Grenzen eine einheitliche Struktur und Zusammensetzung und ist durch Phasengrenzen von anderen Bereichen getrennt. Eine Phase kann flüssig sein, eine feste Lösung darstellen oder eine eigenständige intermetallische Phase, sofern eine solche im System stabil ist.
Ebenso zentral sind die Komponenten, also die Stoffe, aus denen sich eine Legierung zusammensetzt, in der Regel chemische Elemente. Ein binäres Diagramm beschreibt ein System mit zwei Komponenten. Es handelt sich damit nicht um die Beschreibung „einer“ Legierung, sondern um eine gesamte Legierungsfamilie: Jede Zusammensetzungsänderung verschiebt den betrachteten Punkt auf der horizontalen Achse und führt potenziell in andere Phasenfelder.
Die Gibbs’sche Phasenregel als Ordnungsprinzip
Der Unterschied zwischen reinen Metallen und Legierungen ist nicht nur empirisch, sondern thermodynamisch begründet. Legierungen werden von mehr Variablen bestimmt, und genau hier setzt die Gibbs’sche Phasenregel an. Sie verknüpft die Anzahl der Komponenten, die Zahl gleichzeitig vorhandener Phasen und die Anzahl der Freiheitsgrade, also der unabhängigen Zustandsgrößen, die das System variieren darf, ohne aus dem Gleichgewicht zu fallen.
In der Metallurgie wird meist bei konstantem Druck gearbeitet, weil Druckeffekte auf metallische Phasenumwandlungen im Vergleich zum Einfluss von Temperatur und Zusammensetzung häufig geringer sind. Der praktische Kern bleibt dennoch derselbe: Ist der Freiheitsgrad stark eingeschränkt, läuft eine Umwandlung zwangsläufig bei einer festen Temperatur ab. Genau dann entstehen die bekannten Haltepunkte der Kühlkurve. Sobald jedoch Zusammensetzung als Variable hinzukommt und mehrere Phasen nebeneinander existieren können, „wandert“ das System durch Zweiphasengebiete. In diesen Bereichen ändern sich die Zusammensetzungen der beteiligten Phasen mit der Temperatur. Erstarrung und Festkörperumwandlungen verlaufen dann gestreckt über einen Temperaturbereich, und die Struktur entsteht schrittweise.
Wie entsteht ein binäres Gleichgewichtsdiagramm?
Ein binäres Phasendiagramm stellt die Beziehung zwischen Temperatur (vertikale Achse) und Zusammensetzung(horizontale Achse) dar, etwa als Massen- oder Atomprozent einer Komponente. Um ein solches Diagramm experimentell zu gewinnen, wird eine Reihe von Legierungen mit systematisch variierten Anteilen hergestellt. Anschließend werden die Temperaturen erfasst, bei denen Umwandlungen auftreten. Typisch sind thermische Analysemethoden, die Heiz- und Kühlkurven auswerten und die Energieeffekte der Phasenumwandlungen sichtbar machen.
Im Diagramm sind insbesondere die Grenzen der Phasenfelder relevant. Die Liquiduslinie trennt den vollständig flüssigen Bereich von dem Feld, in dem Flüssigkeit und feste Phase gemeinsam vorliegen. Die Soliduslinie markiert die Grenze, unterhalb derer das System vollständig fest ist. Zwischen beiden Linien liegt meist ein Zweiphasengebiet, beispielsweise „Flüssigkeit + feste Lösung“. Das bedeutet praktisch: Ein Teil der Legierung ist bereits erstarrt, während der Rest noch als Schmelze vorliegt.
Um die Zusammensetzung der koexistierenden Phasen bei einer bestimmten Temperatur zu bestimmen, nutzt man eine Isotherme: Man zieht eine horizontale Linie durch das Diagramm. Der Schnittpunkt mit der Liquiduslinie liefert die Zusammensetzung der Flüssigkeit, der Schnittpunkt mit der Soliduslinie die der festen Phase im Gleichgewicht bei genau dieser Temperatur. Dieses Ablesen ist das zentrale Werkzeug, um aus dem Diagramm auf den tatsächlichen Ablauf beim Abkühlen zu schließen.
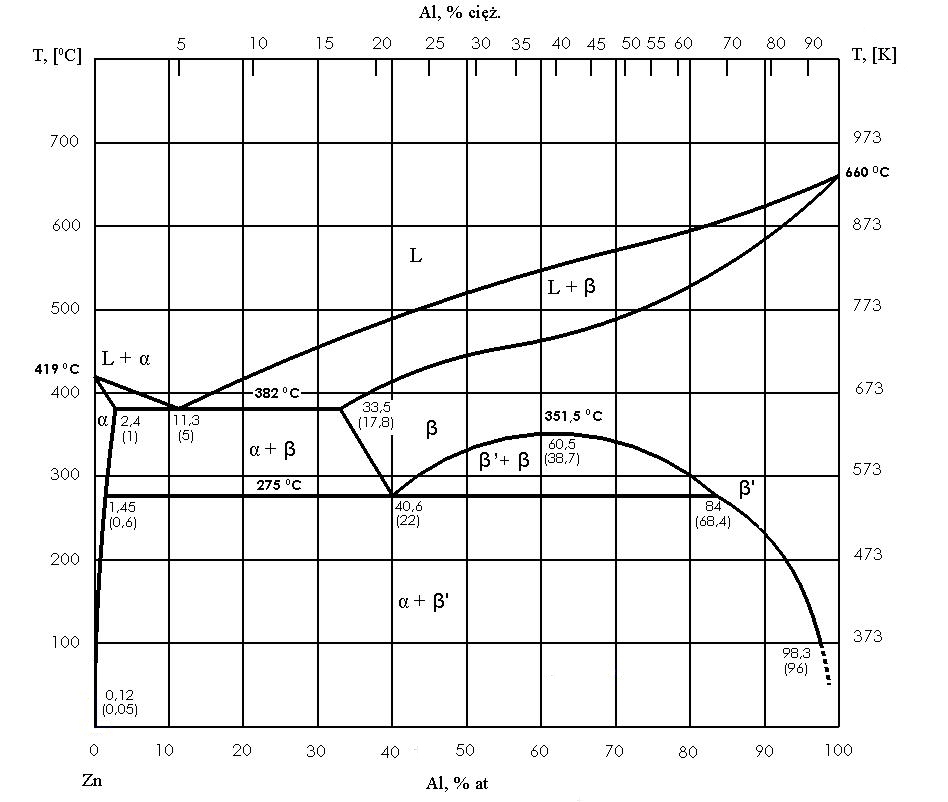
Typische Gleichgewichtssysteme und ihre Charakteristika
Kontinuierliche feste Lösung
In manchen binären Systemen lösen sich die Komponenten sowohl in der Schmelze als auch im festen Zustand vollständig ineinander. Unterhalb der Soliduslinie existiert dann nur eine Phase: eine feste Lösung, deren Zusammensetzung kontinuierlich mit dem Legierungsgehalt variiert. Die Erstarrung setzt beim Erreichen der Liquiduslinie ein, wenn die ersten Kristalle entstehen. Sie endet an der Soliduslinie, sobald der letzte Schmelzrest verschwunden ist. Ein scharfer Erstarrungspunkt fehlt; die Umwandlung läuft über einen Temperaturbereich.
Wichtig ist dabei: Im Zweiphasengebiet „Flüssigkeit + feste Lösung“ unterscheiden sich die Zusammensetzungen beider Phasen und verschieben sich mit der Temperatur. Über die Isotherme lässt sich deshalb nicht nur die Zusammensetzung, sondern indirekt auch der Erstarrungsfortschritt bestimmen, also wie viel bereits fest und wie viel noch flüssig ist.
Eutektisches System
Eutektische Systeme sind typisch für Legierungen, deren Komponenten sich im flüssigen Zustand gut mischen, im festen Zustand jedoch kaum lösen. In einem solchen Diagramm gibt es eine eutektische Temperatur und eine eutektische Zusammensetzung. Genau dort erstarrt eine homogene Flüssigkeit isotherm zu zwei festen Phasen gleichzeitig. Die Kühlkurve zeigt dann eine deutliche Plateauphase, ähnlich wie beim reinen Metall, nur mit einem anderen Ergebnis: Es bildet sich keine einzelne feste Phase, sondern eine feine Zweiphasenmischung, häufig mit charakteristischer, regelmäßiger Morphologie.
Bei Zusammensetzungen, die vom Eutektikum abweichen, entsteht eine Mischstruktur aus Primärkristallen und Eutektikum. Liegt die Legierung auf der einen Seite der eutektischen Zusammensetzung, scheiden sich zuerst Primärkristalle der einen Phase aus; erst anschließend erstarrt der verbleibende Schmelzrest eutektisch. Auf der anderen Seite passiert dasselbe mit der jeweils anderen Phase. Die Mikrostruktur hängt dadurch stark vom Gehalt ab: Mal dominiert das Eutektikum, mal die Primärphase, mal liegen beide Anteile in vergleichbarer Größenordnung vor.
Eutektikum mit begrenzter Löslichkeit im festen Zustand
In der Praxis ist der „Null-Löslichkeit“-Fall selten. Häufig bilden die Komponenten zwar im flüssigen Zustand eine einheitliche Schmelze, im festen Zustand jedoch nur begrenzt lösliche feste Lösungen. Statt reiner Phasen entstehen dann Grenzlösungen, klassisch als α und β bezeichnet. Das Eutektikum besteht folglich aus einer Mischung dieser beiden gesättigten Lösungen bei eutektischer Temperatur.
Dieses Detail ist für die Werkstoffentwicklung entscheidend. Bei weiterer Abkühlung sinkt die Löslichkeit im festen Zustand oft ab. α- und β-Phasen können dadurch übersättigt werden und beginnen nach der Erstarrung sekundär auszuscheiden. Die Struktur „reift“ nach, selbst wenn die Schmelze längst erstarrt ist. Ein Phasendiagramm beschreibt in solchen Fällen nicht nur die Kristallisation, sondern liefert zugleich Hinweise auf spätere Festkörperprozesse, die Härte, Zähigkeit oder Korrosionsverhalten beeinflussen können.
Peritektische Systeme
Peritektische Systeme sind dadurch gekennzeichnet, dass eine Flüssigkeit mit einer bereits vorhandenen festen Phasereagiert und dabei eine neue feste Phase bildet. Diese Reaktion erfolgt bei einer definierten Temperatur, weil zum Zeitpunkt der Umwandlung drei Phasen im Gleichgewicht stehen. Technologisch ist der peritektische Mechanismus heikel: Die neu entstehende Phase wächst häufig als Schicht auf der ursprünglichen festen Phase. Damit entsteht eine Diffusionsbarriere, die den Stofftransport verlangsamt. Die Folge ist, dass reale Gefüge bei endlichen Abkühlraten vom idealen Gleichgewichtsbild abweichen können.
Gerade hier zeigt sich eine Grenze des Phasendiagramms: Es beschreibt das thermodynamische Gleichgewicht, nicht automatisch den Zustand, der sich ohne ausreichende Zeit für Diffusion und Homogenisierung tatsächlich einstellt. Kinetik ist deshalb bei peritektischen Umwandlungen kein Nebenthema, sondern oft der Schlüssel zur richtigen Interpretation.
Begrenzte Mischbarkeit in der Schmelze und monotektische Umwandlungen
Nicht jedes System ist selbst im flüssigen Zustand vollständig homogen. Unter bestimmten Bedingungen kann sich eine Schmelze in zwei Flüssigkeiten mit unterschiedlicher Zusammensetzung entmischen. Solche Flüssig-Flüssig-Zweiphasengebiete begünstigen Segregation und lokale Unterschiede in Eigenschaften. In diesen Systemen kann eine monotektische Umwandlung auftreten, bei der eine Flüssigkeit in eine zweite Flüssigkeit und eine feste Phase übergeht.
Für die Gusstechnik ist das kritisch, weil Entmischung Heterogenität fördert. Technologisch versucht man daher, Entmischungsphänomene zu unterdrücken oder zeitlich zu begrenzen, etwa durch geeignete Abkühlführung oder durch intensives Mischen der Schmelze, solange die Viskosität dies zulässt.
Chemische Verbindungen und intermetallische Phasen
Viele Legierungssysteme bilden chemische Verbindungen oder intermetallische Phasen. Hat eine Verbindung eine feste stöchiometrische Zusammensetzung, erscheint sie im Diagramm an einer charakteristischen Stelle, die genau diesem Verhältnis entspricht. Solche Phasen können kongruent schmelzen, also in eine Flüssigkeit gleicher Zusammensetzung übergehen, oder sie entstehen beziehungsweise verschwinden über peritektische Reaktionen.
Intermetallische Phasen sind oft hart und spröde. Ihr Auftreten kann die mechanischen Eigenschaften einer Legierung drastisch verändern, insbesondere die Plastizität. Umgekehrt können fein verteilte intermetallische Ausscheidungen gezielt zur Festigkeitssteigerung genutzt werden. Phasendiagramme sind deshalb bei der Legierungsentwicklung unverzichtbar: Sie zeigen, in welchen Zusammensetzungs- und Temperaturbereichen kritische Phasen auftreten und wo sich stabile, verarbeitungsfreundliche Gefüge einstellen lassen.
Festkörperumwandlungen: eutektoid und peritektoid
Phasendiagramme enden nicht mit dem Erstarren. Viele Legierungen verändern sich im festen Zustand weiter, etwa weil die Löslichkeit mit sinkender Temperatur abnimmt oder weil eine Komponente polymorph ist. Besonders wichtig ist die eutektoide Umwandlung. Sie ist das Festkörperpendant zur eutektischen Reaktion: Eine feste Lösung zerfällt bei konstanter Temperatur in zwei feste Phasen. Häufig entstehen dabei sehr feine, regelmäßig aufgebaute Strukturen, die die mechanischen Eigenschaften deutlich beeinflussen können.
Daneben existiert die peritektoide Umwandlung, analog zur Peritektik, nur ohne Flüssigkeit: Zwei feste Phasen reagieren miteinander und bilden eine dritte feste Phase. Solche Festkörperprozesse entscheiden in der Praxis oft über Härte, Schlagzähigkeit oder Kriechbeständigkeit, selbst wenn die Erstarrung „nach Lehrbuch“ verlaufen ist.
Praktische Bedeutung: Struktur schlägt Chemie
Die zentrale Erkenntnis aus Phasendiagrammen ist ebenso schlicht wie folgenreich: Legierungseigenschaften ergeben sich primär aus der Mikrostruktur, nicht allein aus der Liste der enthaltenen Elemente. Einphasige Legierungen sind meist homogener; ihre Eigenschaften verändern sich häufig kontinuierlicher mit der Zusammensetzung. Mehrphasige Legierungen sind komplexer. Hier bestimmen Phasenart, Phasenanteil, Verteilung, Korngröße und Morphologie das Verhalten des Werkstoffs. Ob ein Eutektikum lamellar oder globular ausgebildet ist, ob Ausscheidungen fein oder grob sind, ob Körner klein oder groß ausfallen, entscheidet über Festigkeit, Zähigkeit und Verarbeitbarkeit.
Ein Phasendiagramm verknüpft deshalb Prozessbedingungen mit dem resultierenden Gefüge. Wer weiß, bei welchen Temperaturen bestimmte Phasen stabil sind, kann Legierungsgehalte und Wärmebehandlungen zielgerichtet wählen. Daraus ergeben sich konkrete Entscheidungen: Neigt ein System zur Entmischung? Treten spröde intermetallische Phasen auf? Lassen sich Ausscheidungen zur Verfestigung nutzen? Bleibt das Gefüge unter Betriebsbedingungen stabil oder verändert es sich mit der Zeit?
Phasengleichgewichtssysteme von Legierungen: Zusammenfassung
Phasengleichgewichtsdiagramme machen das Verhalten von Legierungen nicht automatisch einfach, aber sie machen es lesbar. Sie zeigen, welche Phasen unter bestimmten Bedingungen stabil sind, wann Erstarrung beginnt und endet, ob eutektische oder peritektische Reaktionen auftreten und welche Umwandlungen im festen Zustand zu erwarten sind. Für die Werkstoffpraxis bedeutet das Zugriff auf die Mikrostruktur als Stellgröße. Wer Phasendiagramme sicher interpretiert, kann Eigenschaften nicht nur erklären, sondern gezielt einstellen. Genau darin liegt ihr Wert: Sie übersetzen Thermodynamik in belastbare Werkstoff- und Prozessentscheidungen.