Keramika jako biomedicínský materiál

Obsah
Keramika se běžně spojuje s porcelánem, sklem nebo architektonickými prvky. V biomedicínském inženýrství má však tento pojem mnohem širší význam. Keramika je anorganický, nekovový materiál, jehož hlavními složkami jsou obvykle oxidy kovů, křemičitany, karbidy nebo nitridy. Vyznačuje se vysokou tvrdostí, vysokou pevností v tlaku, vysokou teplotou tání a velmi nízkou elektrickou a tepelnou vodivostí. Na atomární úrovni jsou její vlastnosti dány především převahou iontových nebo kovalentních vazeb a omezeným počtem možných klouzavých rovin v krystalové mřížce. Proto se keramika na rozdíl od kovů snadno plasticky nedeformuje.
Hlavním důsledkem této struktury je křehkost. Keramika má tendenci praskat v přítomnosti mikrotrhlin, vměstků nebo ostrých zářezů. Namísto postupné deformace, jak je tomu u kovů, se keramika náhle a relativně prudce zlomí, když napětí v blízkosti existující vady překročí kritickou hodnotu. To vysvětluje, proč je její pevnost v tahu mnohem nižší než pevnost v tlaku. Zajímavé je, že za ideálních podmínek, kdy je materiál prakticky bez vad, může být keramika extrémně pevná – příkladem jsou skleněná mikrovlákna s pevností v tahu několika gigapascalů, která převyšuje pevnost mnoha vysokopevnostních ocelí.
Keramika je také materiál, který při pokojové teplotě prakticky nevykazuje tečení. Zatímco kovy se mohou při dlouhodobém namáhání postupně deformovat, keramika si díky své tuhé vazebné struktuře zachovává své rozměry až do vzniku trhliny. Tato vlastnost je výhodou z hlediska stabilního přenosu zatížení, ale zároveň i nevýhodou, protože neschopnost „uvolnit“ napětí prostřednictvím plastické deformace podporuje náhlé zlomení.
Obor biokeramiky vznikl, když se keramika začala vědomě používat pro kontakt s tělesnými tkáněmi. Ukázalo se, že vhodně zvolené keramické složení lze použít nejen v elektronice nebo průmyslu pracujícím s vysokými teplotami, ale také k nahrazení kostních fragmentů, rekonstrukci zubů, konstrukci kloubních implantátů a dokonce i prvků, které přicházejí do styku s krví, jako jsou umělé srdeční chlopně. Musí však být splněno několik základních biologických kritérií.
Aby byl keramický materiál považován za biokeramický, musí být netoxický, nekarcinogenní, nealergenní, nesmí vyvolávat chronické zánětlivé reakce, musí být biokompatibilní a zachovávat si svou biofunkčnost po celou dobu předpokládané implantace. Jinými slovy, nesmí způsobovat škody, musí plnit svou mechanickou nebo biologickou funkci a nesmí se nepředvídatelně rozkládat.
Na tomto základě se biokeramika dělí do tří hlavních tříd. První třídu tvoří neabsorbovatelná keramika, tj. relativně biokompatibilní keramika, která se po implantaci prakticky nerozpouští ani neprochází významnými strukturálními změnami a je navržena tak, aby sloužila po mnoho let. Druhou skupinu tvoří biologicky rozložitelné (resorbovatelné) keramiky, které jsou určeny k postupnému nahrazení rostoucí tkání hostitele. Třetí kategorii tvoří bioaktivní, povrchově reaktivní biokeramiky, jejichž úkolem je vytvořit silnou chemickou vazbu s kostí nebo jinou tkání, především prostřednictvím reakcí, které probíhají pouze v povrchové zóně.

Relativně biokompatibilní biokeramika
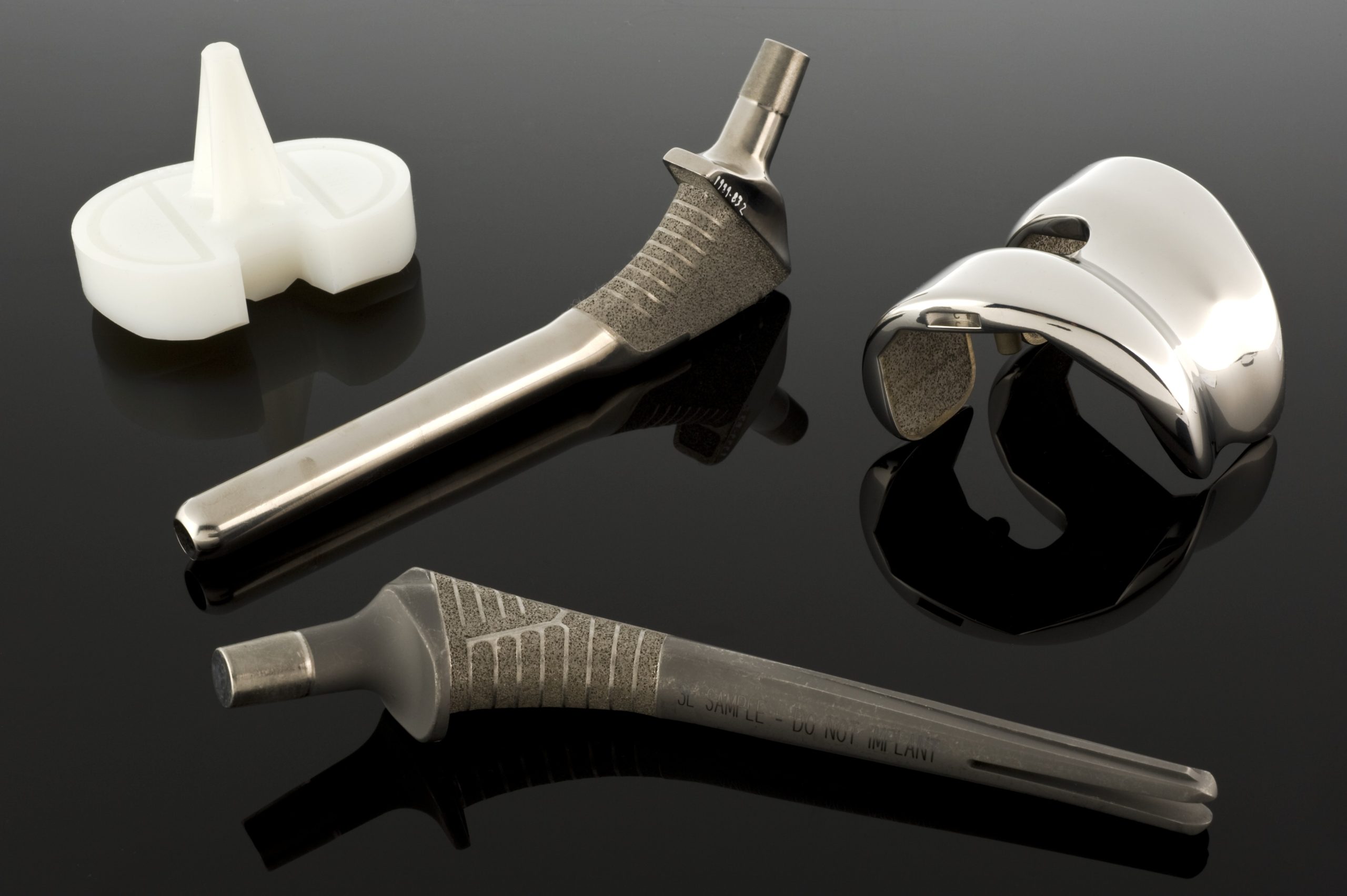
Relativně biokompatibilní biokeramika si zachovává své fyzikální a mechanické vlastnosti i při dlouhodobém použití v těle. Nerozpouští se v žádném významném rozsahu, je odolná vůči korozi a opotřebení a kontakt s tkáněmi se obvykle omezuje na mechanickou adaptaci nebo integraci bez významných chemických reakcí. V této skupině jsou zvláště důležité oxid hlinitý, oxid zirkoničitý a různé druhy uhlíku, včetně pyrolytického uhlíku.
Oxid hlinitý, známý také jako alumina (Al₂O₃), je jedním z nejčastěji používaných keramických materiálů v implantologii. V biomedicínských aplikacích se používá vysoce čistá alfa varianta, ve které obsah Al₂O₃ přesahuje 99,5 % a množství nečistot, jako je oxid křemičitý a oxidy alkalických kovů, je omezeno na desetiny procenta. Aluminium oxid má romboedrickou krystalovou strukturu a v přírodě se vyskytuje jako safír nebo rubín, v závislosti na přítomných nečistotách, které mu dodávají barvu. Jednokrystalické formy tohoto materiálu lze získat postupným tavení prášku na krystalovém zárodku, ze kterého se „vytáhne“ rostoucí krystal.
Mechanické vlastnosti oxidu hlinitého jsou impozantní. Jeho Youngův modul dosahuje několika set gigapascalů, jeho pevnost v ohybu přesahuje 400 MPa a jeho tvrdost se pohybuje od 20 do 30 GPa. Poslední uvedená hodnota znamená, že oxid hlinitý zaujímá velmi vysoké místo na Mohsově stupnici (9/10) a je druhý hned po diamantu. Pevnost a spolehlivost polykrystalického oxidu hlinitého však významně závisí na velikosti zrn a pórovitosti. Snížení pórovitosti a použití jemnozrnné struktury zvyšuje pevnost a snižuje rozptyl výsledků.
Díky kombinaci tvrdosti, odolnosti proti opotřebení a chemické inertnosti v těle je oxid hlinitý ideálním materiálem pro výrobu kluzných prvků v kloubních endoprotézách, zejména hlavicích kyčelních protéz, které spolupracují s polyetylenovými jamkami s ultra vysokou molekulovou hmotností. Studie implantátů z oxidu hlinitého vložených do lebky neprokázaly žádnou toxicitu, žádné známky odmítnutí a velmi dobrou snášenlivost během dlouhého období pozorování. Oxid hlinitý našel uplatnění také v zubních implantátech, kostních dlahách a šroubech, rekonstrukcích středního ucha a součástech vyžadujících vysokou tvrdost a chemickou inertnost.
Druhým klíčovým materiálem v této skupině je oxid zirkoničitý (ZrO₂). V čisté formě má složitý fázový diagram – při různých teplotách nabývá různých krystalických struktur, což je doprovázeno významnými změnami objemu. Taková variabilita je z hlediska rozměrové stability nevýhodná, proto se v praxi používá zirkonium částečně stabilizované oxidy, jako je Y₂O₃. Díky těmto přísadám je možné stabilizovat vysokoteplotní fáze (tetragonální nebo kubické) i při nižších teplotách, což zlepšuje stabilitu struktury po slinování.
Částečně stabilizovaný zirkon má nižší modul pružnosti než oxid hlinitý, díky čemuž se více podobá kosti a zároveň vykazuje obzvláště dobrou odolnost proti zlomeninám. Je to dáno mechanismem transformačního zpevnění – v blízkosti šířící se zlomeniny dochází k lokální fázové přeměně, která je doprovázena mírným zvětšením objemu, což zlomeninu „uzavře“ a brání jejímu dalšímu šíření. Biokompatibilita zirkonu je velmi dobrá a jeho parametry tření a opotřebení při použití s UHMWPE jsou tak příznivé, že tento materiál našel uplatnění v hlavách kloubních endoprotéz a dalších nosných prvcích.
Různé formy uhlíku hrají mezi bioinertními keramickými materiály zvláštní roli. Krystalová struktura grafitu, klasické formy uhlíku, sestává z plochých šestiúhelníkových sítí atomů spojených silnými kovalentními vazbami, uspořádaných do vrstev. Mezi vrstvami dochází k slabším interakcím, které usnadňují jejich vzájemný pohyb a vysvětlují mazivost grafitu. V materiálech, jako je pyrolytický uhlík nebo sklovitý uhlík, jsou tyto šestiúhelníkové vrstvy částečně narušeny, deformovány a smíchány s amorfními oblastmi. V makroskopickém měřítku to vede k izotropnějším mechanickým vlastnostem.
Pyrolytický uhlík je obzvláště cenný v implantologii, protože se vyznačuje vysokou pevností, slušným modulem pružnosti a vynikající kompatibilitou s krví. Tento materiál se nejčastěji používá jako povlak nanášený z plynné fáze na finální tvary implantátů, např. komponenty srdečních chlopní nebo cévní protézy. Procesní parametry, jako je teplota, tlak, složení plynu, geometrie reaktoru a doba depozice, umožňují velmi přesné nastavení hustoty, anizotropie, velikosti krystalitů a přítomnosti defektů v uhlíku. Vyšší hustota obvykle znamená vyšší pevnost a modul pružnosti, což je rozhodující pro dlouhodobou bezpečnost implantátů.
Existují také uhlík-uhlíkové kompozity, ve kterých uhlíková vlákna vyztužují uhlíkovou matrici. Dosahují velmi vysoké pevnosti ve směru vláken, ale jsou výrazně anizotropní a porézní. Z mechanického hlediska mohou být atraktivní, ale jejich použití vyžaduje velmi pečlivé plánování rozložení zatížení v karoserii.
Biologicky rozložitelné biokeramiky
V mnoha aplikacích není cílem trvalá náhrada tkáně, ale dočasné vyplnění defektu, poskytnutí mechanické podpory nebo dodání léčiva, po kterém by měl být implantát postupně nahrazen regenerující se hostitelskou tkání. V takových situacích jsou ideální volbou resorbovatelné keramiky, které se rozkládají kontrolovaným způsobem.
Historicky jedním z prvních materiálů tohoto typu byla sádra, neboli dihydrát síranu vápenatého, který se již na konci 19. století používal jako náhrada kostní tkáně. Skutečný průlom však nastal v druhé polovině 20. století, kdy se objevily plně syntetické fosforečnany vápenaté a složitější systémy, jako jsou keramika z hliníku, vápníku a fosforečnanu (ALCAP), fosforečnan zinečnatý a vápenatý (ZCAP), fosforečnan zinečnatý, síran a vápenatý (ZSCAP) a fosforečnan železitý a vápenatý (FECAP).
Nejdůležitějším zástupcem této skupiny je hydroxyapatit (HA), chemicky podobný minerální fázi kostí a zubů. Má vzorec podobný Ca₁₀(PO₄)₆(OH)₂ a patří do rodiny apatitů. Strukturálně tvoří šestiúhelníkové hranoly, ve kterých jsou hydroxylové ionty uspořádány ve sloupcích podél osy c a některé z iontů vápníku jsou k nim silně vázány. Zbývající ionty Ca²⁺ doplňují krystalovou mřížku a zajišťují stabilitu struktury. Molární poměr vápníku k fosforu je 10:6 a teoretická hustota se blíží 3,2 g/cm³. Nahrazení iontů OH⁻ ionty F⁻ vede ke zvýšení chemické stability, což vysvětluje, proč fluoridace posiluje zubní sklovinu.
Hydroxyapatit je materiál s výjimečnou biokompatibilitou, protože jeho struktura a chemické složení se velmi podobají struktuře a chemickému složení přirozené kostní tkáně. Po implantaci ve formě granulí nebo porézních bloků se rychle vytvoří nová spongiózní kost a hranice mezi implantátem a kostí často nabývá podoby přímé chemické vazby bez zřetelné vláknité zóny.
Mechanické vlastnosti hydroxyapatitu se mohou výrazně lišit v závislosti na způsobu výroby, velikosti zrn a pórovitosti. Modul pružnosti může dosáhnout hodnoty srovnatelné s přírodními tvrdými tkáněmi, jako je sklovina, dentin nebo kompaktní kost. To umožňuje navrhovat implantáty, jejichž tuhost je přizpůsobena okolní tkáni, což snižuje riziko nežádoucího jevu známého jako stresové stínění, tj. odlehčení a postupná ztráta kosti.
Kromě hydroxyapatitu hraje důležitou roli také β-trifosforečnan vápenatý (β-TCP). Je rozpustnější než HA, což vede k rychlejšímu vstřebávání in vivo při zachování dobré osteokonduktivnosti. Díky tomu je tento materiál vhodný jako dočasná výplň kostních defektů, která postupně mizí s růstem vlastní kosti pacienta. Stejně jako hydroxyapatit se TCP často vyrábí mokrou syntézou z vhodných vápenatých a fosforečných solí, následovanou kalcinací a slinováním. Může tvořit kompozity s aminokyselinami, jako je cystein, které se po smíchání s vodou vážou a tvrdnou v místě implantace, což umožňuje, aby se materiál tvořil přímo v defektu.
Složitější keramické systémy, jako jsou ALCAP, ZCAP, ZSCAP a FECAP, jsou obvykle vícefázové. To znamená, že jejich struktura obsahuje několik různých krystalických fází s různou rozpustností a rychlostí resorpce. Tato struktura umožňuje navrhovat materiály, které se rozkládají v několika fázích: některé fáze mizí rychleji, jiné pomaleji, a během tohoto procesu se uvolňují biologicky důležité ionty, jako je zinek nebo železo. Mohou být také použity jako nosiče léčiv – účinná látka je uzavřena v keramické matrici a postupně se uvolňuje při resorpci implantátu.
Zajímavým příkladem přirozeně se vyskytujícího resorbovatelného materiálu je koralina, tj. kostra korálů, složená převážně z uhličitanu vápenatého ve formě aragonitu. Jednotlivé druhy korálů tvoří jedinečné trojrozměrné porézní struktury, které se velikostí a rozložením pórů podobají trabekulární kosti. Díky tomu jsou materiály jako Biocoral ideální pro vyplňování kostních defektů. Uhličitan vápenatý se postupně resorbuje a nahrazuje se kostí. Kromě toho lze korálové skeletony hydrotermálně přeměnit na hydroxyapatit, přičemž si zachovají svou přirozenou pórovitou strukturu, a kombinují tak výhody chemické podobnosti s kostí s velmi příznivou prostorovou mikrostrukturou.
Bioaktivní povrchově reaktivní biokeramika
Mezi extrémně inertní keramikou a rychleji resorbovatelnými materiály existuje třetí, velmi důležitá skupina – bioaktivní biokeramika, tj. povrchově reaktivní skla, sklokeramika a určité formy hydroxyapatitu. Jejich zvláštností je, že ačkoli objem materiálu zůstává relativně stabilní, povrch aktivně reaguje s tělními tekutinami a vytváří vrstvu, která může vytvořit silnou chemickou vazbu s kostí.
Klasickým příkladem jsou bioaktivní silikátová skla, jako jsou materiály z rodiny Bioglass, a jejich krystalizované protějšky – sklokeramika. Tyto systémy jsou založeny na oxidu křemičitém (SiO₂) s přísadami oxidu vápenatého, oxidu sodného a oxidu fosforečného (V). Po implantaci do těla dochází na povrchu těchto materiálů k řadě reakcí: nejprve dochází k výměně iontů Na⁺ a Ca²⁺ s okolím, což způsobuje lokální změnu pH a iontové aktivity. Dále se vytvoří gelová vrstva bohatá na oxid křemičitý, na které se vysráží fosforečnany vápenaté, které se v průběhu času přemění na strukturu podobnou apatitu. Tato povrchová vrstva apatitu umožňuje kostem ukotvit se přímo do skla, bez zprostředkování vláknité tkáně.
Bioaktivita skla silně závisí na jeho chemickém složení, především na obsahu SiO₂ a poměru CaO, Na₂O a P₂O₅. Existuje specifický rozsah složení, ve kterém se současně tvoří vrstva křemíku a fosfátu. Mimo tento rozsah je materiál buď příliš nereaktivní na to, aby vytvořil trvalou vazbu s tkání, nebo příliš náchylný k rozpuštění.
Sklokeramika, jako jsou krystalizované formy Bioglass nebo Ceravital, se vyrábí jako výsledek řízené krystalizace skla. Během výroby prochází materiál řadou tepelných úprav, které vedou k vytvoření obrovského množství drobných krystalitů (o průměru zlomku mikrometru) rovnoměrně rozložených v celém objemu. Výsledkem je, že sklokeramika kombinuje vysokou hustotu, vysokou pevnost, dobrou odolnost proti poškrábání a vhodné tepelné vlastnosti. Pečlivě vybrané složení umožňuje zachovat bioaktivitu a zároveň zlepšit mechanické parametry ve srovnání s čistě amorfním sklem.
Navzdory těmto výhodám zůstávají bioaktivní sklo a sklokeramika relativně křehkými materiály. Jejich pevnost v tahu se sice zlepšila, ale stále je příliš nízká na to, aby mohly být použity jako samostatné komponenty ve velkých nosných implantátech, jako jsou například dříky kloubních protéz. Jsou však široce používány jako povlaky na kovových implantátech, kde tvoří přímé spojení s kostí, a jako plniva v dentálních kompozitech, materiálech pro rekonstrukci středního ucha a malých lebečních implantátech.
Zhoršení stavu a únava keramiky v těle
Při navrhování keramických implantátů je důležité zohlednit nejen vlastnosti materiálu bezprostředně po výrobě, ale také to, jak se tyto vlastnosti v průběhu času mění pod vlivem biologického prostředí a mechanického zatížení.
U neabsorpční keramiky hrají významnou roli statická a dynamická únava. Ve vodním prostředí, které odpovídá fyziologickým podmínkám, může voda urychlit růst existujících mikrotrhlin. Pokud materiál obsahuje přísady, které usnadňují pronikání vody, může to vést k postupnému snižování pevnosti při dlouhodobém zatížení, i když jsou napětí nižší než mez pevnosti stanovená v krátkodobém testu. Tento jev byl podrobně studován mimo jiné u oxidu hlinitého, přičemž byl pozorován vztah mezi přítomností stop působení vody na povrchu lomu a poklesem pevnosti.
Statistické modely pevnosti, jako je Weibullovo rozdělení, se často používají k popisu chování keramiky, u které závisí pravděpodobnost poruchy na konstantním parametru měřítka a tvaru m. Čím vyšší je hodnota parametru m, tím menší je rozptyl pevnosti a tím větší je předvídatelnost chování materiálu, což je při navrhování komponent implantátů zásadní. Zkoušky pevnosti, při nichž jsou hotové komponenty vystaveny namáhání vyššímu, než je očekávané provozní zatížení, jsou také praktickým nástrojem spolehlivosti. Slabší vzorky jsou během zkoušek zničeny a u zbývajících lze určit minimální očekávanou životnost při dané úrovni zatížení.
V případě uhlíkových povlaků na kovech únavové zkoušky prokázaly, že integrita povlaku silně závisí na chování podkladu. Pokud kovový podklad nepodléhá významné plastické deformaci, pyrolytický uhlík může zůstat neporušený i při velmi vysokém počtu zatěžovacích cyklů, což je zvláště důležité pro potažené srdeční chlopně nebo cévní protézy.
Techniky výroby biokeramiky
Volba technologie výroby biokeramiky závisí do značné míry na zamýšleném použití implantátu. Pokud je cílem nahradit tvrdou tkáň a přenášet mechanické zatížení, bude prioritou vysoká hustota, vysoká pevnost a vhodný modul pružnosti. V aplikacích, kde je nejdůležitější integrace tkáně a intenzivní vaskularizace, hraje klíčovou roli vysoká otevřená pórovitost a správné rozložení velikosti pórů.
Podpůrné implantáty využívají techniky jako vstřikování, lití gelu a metody mikroemulze, které umožňují dosáhnout vysoké hustoty (nad 97–99 % teoretické hustoty) s relativně nízkou pórovitostí. Vhodně zvolené přísady, včetně fosforečnanů sodných, lithia nebo částečně stabilizovaného zirkonia, mohou zlepšit slinovatelnost, zvýšit mikrotvrdost a odolnost proti lomu a ovlivnit vývoj mikrostruktury během slinování. Je třeba vždy mít na paměti, že příliš mnoho přísad nebo jejich nevhodný výběr může vést k tvorbě nebiokompatibilních nebo příliš rozpustných fází.
Pokud je cílem rychlá integrace s kostí a jinými tkáněmi, keramika je navržena tak, aby měla vysokou otevřenou pórovitost s póry o průměru, který umožňuje pronikání krevních cév a buněk (obvykle nejméně několik desítek mikrometrů). Zde se mimo jiné používá metoda konsolidace škrobem, při které se škrobové granule smíchají s keramickou suspenzí a během sušení nabobtnají. Během slinování škrob shoří a na jeho místě zůstanou póry. Úpravou poměru škrobu ve směsi je možné přesně řídit konečnou poréznost a rozložení velikosti pórů a získat struktury s póry o velikosti od několika mikrometrů do desítek mikrometrů.
Další technikou je kapkové lití, při kterém se kapky nebo granule tvoří ze suspenze hydroxyapatitu, například kapáním na speciální formy nebo do kapalného dusíku. Po vysušení, kalcinaci a slinování se získají porézní granule HA, které lze použít jako výplň kostních defektů. Bez ohledu na podrobnosti procesu je cílem vytvořit strukturu, která je dostatečně pevná, aby přežila implantaci a počáteční fázi hojení, a zároveň poskytuje vysoký stupeň penetrace tkáně.
Shrnutí – Keramika jako biomedicínský materiál
Biokeramika je v současnosti jednou z klíčových skupin biomateriálů používaných v medicíně. Zahrnuje relativně bioinertní oxidovou keramiku, jako je oxid hlinitý a zirkonium, stejně jako resorbovatelné fosforečnany vápenaté, struktury na bázi korálů, vícesložkové systémy obsahující zinek nebo železo a bioaktivní skla a sklokeramiku. Každý z těchto materiálů má v těle svou vlastní „roli“: některé jsou určeny jako stabilní, dlouhodobé náhrady kostí, jiné mají postupně ustoupit nové tkáni a další poskytují silnou chemickou kotvu pro implantáty v kosti.
Klíčem k navrhování biokeramiky je pochopení vztahu mezi chemickým složením, krystalovou strukturou, mikrostrukturou, výrobní metodou a chováním v biologickém prostředí. Moderní implantáty velmi často kombinují různé materiály: kov pro přenos zatížení, bioaktivní keramiku pro trvalé spojení s kostí, resorbovatelné nosné struktury pro podporu regenerace a uhlíkové povlaky v komponentách, které přicházejí do styku s krví. Biokeramika již není pouze „tvrdým materiálem“ – dnes je to přesně navržený nástroj pro tkáňové inženýrství a implantologii, který umožňuje stále lepší napodobování biologických funkcí a struktury tkání těla.