Kovové biomateriály

Obsah
Kovy hrají v biomedicínském inženýrství zcela odlišnou roli než keramika nebo polymery. Vyznačují se především vynikajícími mechanickými vlastnostmi a vysokou elektrickou a tepelnou vodivostí. To je dáno povahou kovové vazby – některé elektrony jsou delokalizovány a tvoří oblak „volných elektronů“, které jsou zodpovědné za vodivost a za silnou, byť nesměrovou vazbu mezi kovovými ionty. Tato struktura umožňuje atomům v krystalové mřížce pohybovat se vůči sobě navzájem, aniž by narušily pořadí, což vede k plasticitě charakteristické pro kovy a schopnosti podstoupit velké deformace bez náhlého zničení.
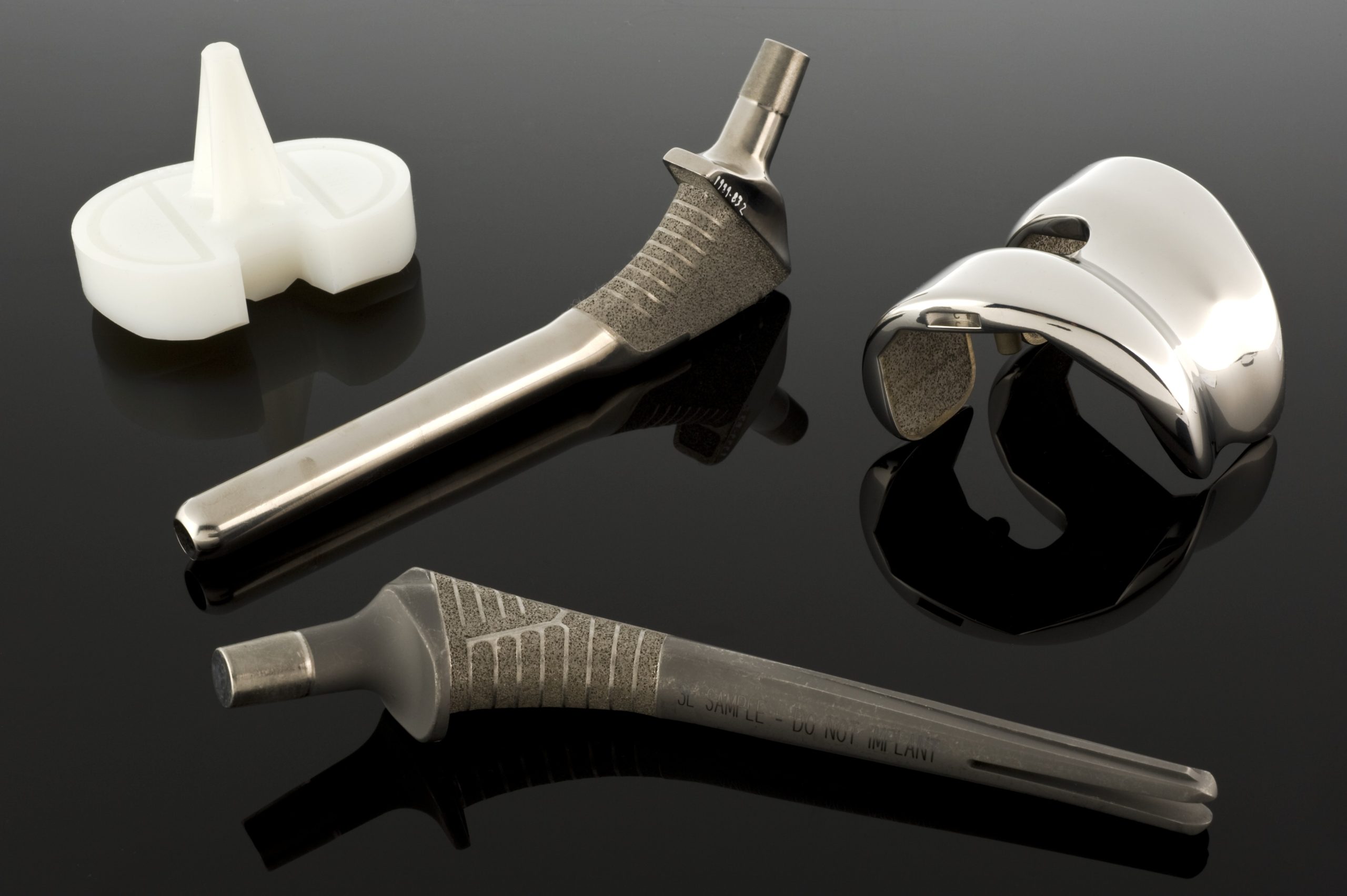
Tato vlastnost se velmi vědomě využívá v biomateriálech. Kovy slouží jak jako pasivní náhrady tvrdých tkání – v kyčelních a kolenních protézách, kostních dlahách, šroubech, intramedulárních hřebech, zubních implantátech – tak jako materiály pro „aktivnější“ zařízení, jako jsou cévní stenty, katétrové vodítka, ortodontické dráty a kochleární implantáty. V těchto aplikacích nezáleží pouze na pevnosti, ale také na tvarovatelnosti, elasticitě, vodivosti a vhodnosti pro přesnou výrobu.
Historie kovových biomateriálů začala s slitinami oceli. První slitinou vyvinutou speciálně pro ortopedické účely byla vanadová ocel, která se používala k výrobě dlah a šroubů pro fixaci zlomenin (známých jako Shermanovy dlahy). Postupem času byla nahrazena nerezovými ocelemi a později slitinami kobaltu a chromu a slitinami titanu. Tyto slitiny obsahují řadu kovů – železo (Fe), chrom (Cr), kobalt (Co), nikl (Ni), titan (Ti), tantal (Ta), niob (Nb), molybden (Mo) a wolfram (W) – které jsou ve větších dávkách toxické pro organismus, ale ve formě stabilních, korozivzdorných slitin jsou dobře snášeny.
Hlavním problémem při používání kovů je koroze v živém organismu. Produkty koroze mohou vést jak k oslabení samotného implantátu, tak k nežádoucím biologickým reakcím – lokálnímu zánětu, změně barvy tkáně, poškození orgánů nebo imunitní reakci. Moderní inženýrství kovových biomateriálů se proto zaměřuje na slitiny schopné vytvářet odolné pasivní ochranné vrstvy na povrchu a na vědomou modifikaci povrchu, aby se dosáhlo dobré pevnosti, vysoké odolnosti proti korozi a vhodné biologické reakce.
Nerezové oceli jako implantátové materiály
Nerezová ocel byla jedním z prvních materiálů, které úspěšně nahradily vanadovou ocel v implantátech. Zpočátku se používala ocel 18-8 (typ 302) obsahující přibližně 18 % chromu a 8 % niklu, která měla výrazně lepší odolnost proti korozi než klasické uhlíkové oceli. Postupem času se objevila varianta 18-8 s přídavkem molybdenu (18-8sMo), dnes známá jako ocel 316, následovaná modifikací se sníženým obsahem uhlíku – ocel 316L. Snížení obsahu uhlíku z přibližně 0,08 % na maximálně 0,03 % snižuje tendenci k tvorbě karbidů chromu na hranicích zrn, což zlepšuje odolnost proti korozi v prostředí bohatém na chloridy, jako jsou tělesné tekutiny.
Chrom je primárně zodpovědný za odolnost proti korozi nerezových ocelí. I při obsahu Cr 11 % se na povrchu vytvoří tenká ochranná vrstva oxidu, která oceli dodává takzvaný pasivní stav. Přidání molybdenu zvyšuje odolnost proti důlkové korozi v chloridovém prostředí, díky čemuž jsou oceli 316/316L vhodnější pro fyziologické podmínky. Nikl zase stabilizuje austenitickou fázi (γ, fcc struktura) při pokojové teplotě, čímž materiál činí nemagnetickým a zlepšuje jeho odolnost proti korozi.
Austenitické oceli nelze kalit konvenčním tepelným zpracováním, ale velmi dobře reagují na tvrzení za studena. To umožňuje upravit širokou škálu mechanických vlastností – od více tažných, měkkých struktur až po výrazně tvrzené struktury s vysokou pevností v tahu. Mechanické údaje pro ocel 316L ukazují, že v závislosti na stupni studené deformace lze dosáhnout různých kombinací pevnosti a tažnosti, což je důležité pro přizpůsobení materiálu konkrétní funkci implantátu.
Navzdory svým mnoha výhodám nejsou oceli 316 a 316L ideálními materiály. Za podmínek vysokého namáhání, zejména v oblastech s omezeným přístupem kyslíku, jako jsou oblasti kolem závitů šroubů nebo spojů kostních dlah, může docházet ke vzniku štěrbinové a důlkové koroze a v dlouhodobém horizontu také k únavové korozi. Z tohoto důvodu se nerezové oceli nejčastěji používají v dočasných implantátech, jako jsou dlahy, šrouby, hřebíky a fixační dráty, které lze po zhojení kosti odstranit. Ke zlepšení jejich vlastností se široce používají povrchové úpravy – od leštění a pasivace v kyselině dusičné až po eloxování nebo implantaci dusíku pomocí výboje, což zvyšuje odolnost proti korozi, opotřebení a únavě.
Slitiny kobaltu a chromu
Když mechanické požadavky přesahují možnosti nerezových ocelí, přicházejí na řadu slitiny kobaltu a chromu. V biomateriálech existují dvě hlavní skupiny těchto slitin: litá slitina CoCrMo, která se používá mimo jiné v endoprotetických jamkách a hlavách, a kovaná slitina CoNiCrMo, která se používá v komponentách s vysokým zatížením, jako jsou dříky kyčelních nebo kolenních protéz. Normy ASTM popisují několik verzí těchto materiálů (F75, F90, F562, F563), ale v klinické praxi dominují CoCrMo a CoNiCrMo.
Kobalt a chrom tvoří pevnou směs až do obsahu přibližně 65 % Co a přidání molybdenu způsobuje zjemnění zrna a v důsledku toho zvýšení pevnosti po odlití nebo kování. Chrom hraje dvojí roli: zvyšuje odolnost proti korozi tvorbou pasivní oxidové vrstvy a podílí se na zpevnění roztoku. V klinické praxi se slitiny Co–Cr vyznačují velmi vysokým modulem pružnosti – v rozmezí 220–234 GPa, což je více než u nerezových ocelí, a velmi dobrou odolností proti opotřebení.
Tato vysoká tuhost má však své důsledky. Příliš tuhý implantát může přebírat příliš velkou zátěž, což vede ke stresovému stínění – snížení zátěže na vlastní kost pacienta a její postupné resorpci. Ačkoli klinický význam tohoto jevu není zcela jasný, je to důležitý faktor při navrhování a tvarování protetických dříků. Na druhou stranu tvrdost a odolnost proti otěru činí slitiny kobaltu a chromu vynikající volbou pro „kov-kovové“ třecí páry, kde je zásadní minimalizovat dlouhodobé opotřebení. Studie dlouhodobých endoprotéz s takovými páry ukazují velmi nízkou míru lineárního opotřebení, řádově několik mikrometrů za rok.
Dalším důležitým problémem je uvolňování iontů ze slitin Co-Cr a jejich potenciální toxicita. Experimenty v Ringerově roztoku ukázaly, že rychlost uvolňování niklu ze slitiny CoNiCrMo a oceli 316L je po určité době velmi podobná, i když slitina kobaltu obsahuje asi třikrát více niklu. Studie in vitro ukázaly, že částice kobaltu mohou být toxické pro buňky tvořící kosti, zatímco částice chromu a slitiny Co-Cr jsou mnohem lépe snášeny. Vysoké koncentrace extraktů iontů Co a Ni jasně narušují buněčný metabolismus v kulturách, zatímco ionty chromu vykazují nižší toxicitu.
Titan a jeho slitiny
Mezi kovy používanými jako biomateriály zaujímá titan zvláštní postavení. V elektrochemické řadě je to „aktivní“ prvek, ale ve fyziologickém prostředí je pokryt velmi stabilní pasivní oxidovou vrstvou, díky níž je jeho korozní proud ve fyziologických roztocích extrémně nízký, řádově 10⁻⁸ A/cm². V praxi zůstávají titanové implantáty po dlouhé době v těle vizuálně nezměněné.
Čistý titan (cp-Ti) a nejoblíbenější slitina Ti–6Al–4V kombinují velmi dobrou odolnost proti korozi s příznivým poměrem pevnosti k hmotnosti. Jejich modul pružnosti je nižší než u oceli nebo slitin Co–Cr, což je přibližuje kosti a potenciálně snižuje riziko stresového stínění. Na druhou stranu titan není tak tuhý ani pevný v tahu jako nejlepší oceli nebo slitiny kobaltu, takže konstrukce nosných prvků vyžaduje přesnou analýzu napětí a často i větší průřez.
V posledních desetiletích byly vyvinuty také slitiny titanu se sníženým modulem pružnosti a zvýšenou odolností proti korozi, které obsahují mimo jiné Nb a Zr, např. Ti–13Nb–13Zr, určené speciálně pro kloubní protézy. Kromě toho bylo vyvinuto povrchové kalení slitin Ti (např. termochemické zpracování, nitridace), které umožňuje kombinovat dobrou biokompatibilitu substrátu s vysokou odolností proti opotřebení v třecích zónách.
Zvláštní skupinu tvoří slitiny niklu a titanu (NiTi), které vykazují tvarovou paměť a superelasticitu. Díky martenzitické transformaci mohou při zahřátí nad transformační teplotu reprodukovat dříve zaznamenaný tvar nebo vykazovat velmi vysokou elastickou deformovatelnost v úzkém rozsahu napětí. Tato vlastnost se využívá mimo jiné v cévních stentech, ortodontických obloucích a katétrových vodítkách, což umožňuje atraumatické zavedení zařízení a jejich stabilní expanzi po dilataci.
V případě titanu jsou vlastnosti povrchu obzvláště důležité. Studie ukazují, že jak drsnost, tak chemické složení povrchu regulují chování osteoblastů a kostních buněk – ovlivňují adhezi, proliferaci a produkci růstových faktorů a cytokinů. Vhodná chemická úprava povrchu titanu a jeho slitin může způsobit, že se stanou bioaktivními, tj. schopnými tvořit vrstvu apatitu při kontaktu s tělními tekutinami, což podporuje přímé spojení s kostí.

Kovy v zubním lékařství a dalších speciálních aplikacích
V zubním lékařství se používají jak drahé kovy, tak i obecné kovy. Zlato je prakticky odolné proti korozi (odolnost typu imunity) a poskytuje vynikající trvanlivost a chemickou stabilitu v protetických rekonstrukcích. Jeho omezeními jsou však vysoká hustota, nedostatečná pevnost pro těžká zatížení a cena, což znamená, že se prakticky nepoužívá v ortopedii.
Běžně se používá zubní amalgám, slitina stříbra, cínu a rtuti. Ačkoli jednotlivé fáze tohoto materiálu jsou při neutrálním pH pasivní, v praxi amalgám často koroduje, zejména v případě rozdílů v provzdušnění pod bakteriálním povlakem a lokálních galvanických mikrobuněk. Ve skutečnosti se jedná o materiál nejvíce náchylný ke korozi používaný v zubním lékařství, což se projevuje zabarvením a tvorbou produktů koroze na povrchu výplní.
Do skupiny speciálních kovů patří také platinové kovy a jejich slitiny, které se používají tam, kde je rozhodující chemická odolnost a regulace vodivosti, stejně jako slitiny Ni-Cu a další systémy používané v hypertermii – záměrném zahřívání nádorových tkání pomocí indukovaného magnetického pole. Tyto typy slitin jsou navrženy tak, aby jejich tepelná odezva v elektromagnetickém poli byla dobře regulována, což umožňuje přesné dodávání tepelné energie do nádoru.
Koroze kovových implantátů v biologickém prostředí
Koroze je ústředním jevem u kovových biomateriálů. V těle máme co do činění s elektrolytickou tekutinou obsahující ionty (Na⁺, Cl⁻, HCO₃⁻, fosfáty), proměnlivé pH a potenciální rozdíly mezi různými oblastmi – všechny tyto faktory podporují elektrochemické reakce.
Pourbaixovy diagramy, které znázorňují vztah mezi elektrochemickým potenciálem a pH, se používají k popisu stability kovů. Rozlišují mezi oblastmi koroze (aktivity), pasivity a imunity. V lidském těle mají různé tekutiny různé hodnoty pH a kyslíku: tkáňová tekutina má obvykle pH kolem 7,4, ale v okolí rány může klesnout až na 3,5 a v infikované ráně může stoupnout až na 9,0. To znamená, že kov, který má dobré vlastnosti v jedné oblasti těla, může v jiné oblasti korodovat.
Pourbaixovy diagramy však mají svá omezení – vycházejí z rovnovážných stavů v jednoduchém systému kov-voda-reakční produkty. Přítomnost chloridových iontů nebo komplexních organických molekul může výrazně změnit chování kovu a předpokládaná pasivita se v praxi může ukázat jako příliš optimistická. Proto se kromě těchto diagramů používají polarizační křivky, které umožňují určit korozní proud a na tomto základě vypočítat počet iontů uvolněných do tkání a rychlost ztráty materiálu. Alternativně se měří ztráta hmotnosti vzorku během expozice v roztoku podobném tělní tekutině.
Koroze implantátových materiálů může mít různé formy. Rovnoměrná koroze vede k relativně homogenní ztrátě materiálu, ale lokalizované formy jsou mnohem nebezpečnější. Důlková koroze způsobuje hluboké, lokalizované ztráty – nerezové oceli jsou k tomu obzvláště náchylné v přítomnosti chloridů. Špalíková koroze se vyskytuje v oblastech s omezeným přístupem kyslíku, jako jsou mezery mezi šroubem a deskou, kde se místní chemické podmínky (pH, koncentrace iontů) výrazně liší od okolního prostředí. Fretting je koroze spojená s mikropohyby dvou kontaktních povrchů – mechanické odírání ničí pasivní vrstvu, odhaluje čerstvý kov a urychluje korozi.
Korozní únava a korozní únava jsou zvláštní formy koroze. Při mechanickém namáhání, zejména opakovaném, se může rychlost koroze zvýšit a mikrotrhliny se mohou šířit rychleji. Například u implantátů z nerezové oceli byly pozorovány zlomeniny kyčelních hřebů a čepů, kde současně působily ohybové zatížení a agresivní fyziologické prostředí. V takových případech je obtížné hovořit o „čisté“ korozi – vždy se jedná o dynamickou interakci chemie, mechaniky a mikrostruktury.
Různé kovy se v tomto ohledu chovají odlišně. Drahé kovy, jako je zlato, jsou prakticky odolné proti korozi – jejich standardní elektrochemický potenciál je kladný a v Pourbaixových diagramech zaujímají oblast imunity. Titan a slitiny Co–Cr jsou založeny na pasivitě – vytvářejí dobře přilnavou, pevnou vrstvu oxidu, díky níž jsou jejich korozní proudy velmi nízké a povrch zůstává stabilní. Nerezové oceli také těží z pasivity chromu, ale jejich pasivní vrstva je méně stabilní, což je činí náchylnějšími k důlkové a štěrbinové korozi. Zubní amalgám je naopak, ačkoli je termodynamicky částečně pasivní, v praxi materiálem vysoce náchylným ke korozi, zejména v přítomnosti biofilmu.
Výroba a zpracování kovových implantátů
Výroba kovových implantátů není jen otázkou tvarování geometrie, ale také kontroly mikrostruktury a stavu povrchu, které určují únavovou pevnost, odolnost proti korozi a biologickou reakci.
V případě nerezových ocelí je rozhodující, že austenitické oceli velmi rychle tvrdnou při stlačení. To znamená, že při tváření za studena (válcování, tažení, ohýbání) se zvyšuje jejich pevnost, ale zároveň se snižuje jejich plasticita. K obnovení požadované úrovně deformovatelnosti se používá mezitímní žíhání, při kterém je třeba se vyvarovat teplot a časů, které vedou k vysrážení karbidů chromu na hranicích zrn, což oslabuje odolnost proti korozi. Po tvarování se součásti čistí, deoxidují (chemicky nebo abrazivně) a pasivují, obvykle v roztoku kyseliny dusičné podle normy ASTM F86.
Slitiny Co–Cr se chovají odlišně – jsou velmi náchylné k posílení během deformace, což v mnoha případech ztěžuje konvenční kování. Proto se součásti se složitými geometriemi, jako jsou protetické hlavy a jamky, často vyrábějí pomocí přesného lití (tzv. metodou ztraceného vosku). Tento proces zahrnuje přípravu přesného voskového modelu, jeho pokrytí žáruvzdorným materiálem, vypálení vosku a nalití tekuté slitiny Co-CrMo do formy při vysoké teplotě. Teplota formy a doba chlazení ovlivňují velikost zrn a velikost a rozložení karbidů – jemná mikrostruktura zvyšuje pevnost, ale může snížit odolnost proti křehkému lomu, zatímco větší zrna a karbidy zlepšují tažnost na úkor pevnosti. Konstruktér proto musí najít kompromis mezi pevností a odolností proti lomu.
U titanových slitin jsou rozhodující procesy odlévání, kování a tepelného zpracování, stejně jako povrchová úprava. Titan vyžaduje během zpracování za vysokých teplot ochrannou atmosféru, protože snadno reaguje s kyslíkem a dusíkem a vytváří křehké povrchové vrstvy. Po počátečním mechanickém zpracování jsou povrchy titanových implantátů pískovány, leptány kyselinou, eloxovány nebo kombinací těchto procesů, což vede k příznivé mikrometrové drsnosti a modifikované oxidové vrstvě. Studie ukazují, že takto upravené povrchy podporují rychlejší růst kosti a tvorbu silné mechanické a potenciálně i chemické vazby.
Procesy výroby slitin s tvarovou pamětí tvoří samostatnou kategorii. V jejich případě je rozhodující přesná kontrola chemického složení a tepelného zpracování, které určují teploty martenzitické transformace a rozsah superelasticity. NiTi stenty nebo ortodontické oblouky musí dosáhnout požadované deformace a návratu do tvaru v přesně definovaném teplotním rozsahu, včetně fyziologických podmínek.
Shrnutí – Kovové biomateriály
Kovové biomateriály tvoří rozsáhlou skupinu, ve které každý materiál zaujímá svou vlastní, poměrně přesně definovanou funkční niku. Nerezové oceli, zejména typ 316L, jsou relativně levné a snadno zpracovatelné materiály s dobrými mechanickými vlastnostmi a dostatečnou odolností proti korozi, proto se používají především v dočasných implantátech a méně kritických součástech. Slitiny Co-Cr nabízejí velmi vysokou pevnost, tvrdost a odolnost proti opotřebení, což z nich činí materiál volby pro protetické jamky a hlavy, stejně jako pro dříky, kde je důležitá odolnost při velkém zatížení. Titan a jeho slitiny, které kombinují velmi dobrou odolnost proti korozi, příznivý modul pružnosti a vysokou biokompatibilitu, se staly „zlatým standardem“ pro dlouhodobé implantáty, zejména v ortopedii a dentální implantologii.
Speciální slitiny, jako je NiTi s tvarovou pamětí, také hrají důležitou roli a umožňují zcela nové terapeutické strategie – od samoroztažitelných stentů po superelastické ortodontické oblouky. Zlato a amalgámy zůstávají v zubním lékařství důležité, i když se jejich použití reviduje s ohledem na estetické a bezpečnostní požadavky.
Společným jmenovatelem všech kovových biomateriálů je nutnost kontrolovat korozi a interakci s tkání. Základem pro technický návrh těchto materiálů jsou Pourbaixovy diagramy, polarizační křivky, únavové zkoušky a studie iontové toxicity. Stejně důležitá je i povrchová úprava – určuje kvalitu pasivní vrstvy, odolnost proti opotřebení, adhezi buněk a povahu spojení s kostí.
V důsledku toho moderní biomateriálové inženýrství neposuzuje kovy izolovaně, ale považuje je za součást komplexních systémů: kovové jádro může být potaženo bioaktivní keramikou, obklopeno polymerovým kompozitem nebo může spolupracovat s porézními keramickými strukturami, které podporují regeneraci. Kovy poskytují nosnost a plasticitu, keramika poskytuje bioaktivitu a odolnost proti oděru a polymery poskytují flexibilitu a schopnost tvořit měkké struktury. Společně tvoří základ moderní implantologie, kde cílem již není pouze „nahradit části“, ale dosáhnout funkční, biologicky integrované rekonstrukce orgánů.