Fázové rovnovážné systémy slitin
Obsah
U čistých kovů je průběh přeměn obvykle snadno pochopitelný: tavení a tuhnutí probíhá při jedné přesně definované teplotě, stejně jako některé strukturální přeměny v pevném stavu. Chladicí křivky pak vykazují charakteristické pauzy, protože energie je absorbována nebo uvolňována pro samotnou přeměnu, nikoli pro změnu teploty. V případě slitin již situace není tak „bodová“. Často se stává, že slitina začíná tuhnout při jedné teplotě, ale končí při jiné, a během tohoto procesu koexistují fáze s různým složením.
Proto se v materiálových vědách používají fázové rovnovážné diagramy, známé také jako fázové diagramy. Takový diagram lze považovat za mapu: ukazuje které fáze jsou stabilní v závislosti na teplotě a složení a v jakém pořadí dochází k přeměnám během ohřevu a ochlazování. To umožňuje předpovědět jak průběh krystalizace a následných transformací v pevném stavu, tak v důsledku toho i strukturu a vlastnosti hotové slitiny.
Klíčové pojmy: systém, fáze a komponenty
Abyste mohli správně číst rovnovážné diagramy, musíte rozumět jazyku, kterým „mluví“. V termodynamických pojmech je systém samostatný fragment reality analyzovaný za daných podmínek, například vzorek slitiny, kterou chladíme. Fáze znamená homogenní část systému s identickými vlastnostmi a konstantním chemickým složením, oddělenou od ostatních fází fázovou hranicí. Fáze může být kapalina, pevný roztok nebo specifická intermetalická fáze, pokud se vytvoří.
Důležité jsou také složky, tj. látky (obvykle prvky), které tvoří slitinu a z nichž se mohou tvořit fáze. V kontextu binárních diagramů obvykle odkazujeme na systém složený ze dvou složek, jejichž poměry se v slitině liší. V praxi to znamená, že diagram nepopisuje jediný „materiál“, ale spíše celou řadu slitin s různým složením, a každá změna složení nás posouvá na jiné místo na mapě fází.
Gibbsovo fázové pravidlo
Jedním z důvodů, proč se chování slitin liší od chování čistých kovů, je počet proměnných, které systém „ovládají“. Gibbsovo fázové pravidlo organizuje vztah mezi počtem složek, počtem fází a počtem stupňů volnosti. V metalurgické praxi se často předpokládá konstantní tlak, protože jeho vliv na fázové přechody kovů je obvykle malý ve srovnání s vlivem teploty a složení.
Praktický význam je následující: pokud má systém malý „manévrovací prostor“, musí k přechodu dojít při jedné teplotě (odtud charakteristické zastavení). Pokud však dochází k variabilitě složení a existuje možnost souběžné existence několika fází, může systém procházet oblastmi, kde dochází k souběžnému výskytu dvou fází a jejich složení se mění s teplotou. Poté se tuhnutí nebo přeměny v pevném stavu rozšiřují na určitý teplotní rozsah a struktura se formuje postupně.
Jak se vytváří binární rovnovážný diagram?
Typický binární diagram znázorňuje vztah mezi teplotou a chemickým složením. Vodorovná osa představuje složení slitiny (např. procentuální podíl jedné složky) a svislá osa představuje teplotu. Pro sestavení takového diagramu se provádí řada experimentů s mnoha slitinami s různým poměrem složek a zaznamenávají se teploty, při kterých dochází k přeměnám – nejčastěji metodami termické analýzy na základě křivek ochlazování a ohřívání.
Hranice fázových oblastí jsou v grafu obzvláště důležité. Čára nazývaná liquidus odděluje zcela kapalnou oblast od oblasti, kde kapalina koexistuje s pevnou fází. Čára solidus označuje hranici, pod kterou je slitina zcela pevná. Mezi liquidusem a solidusem se obvykle nachází oblast směsi (např. kapalná + pevná fáze), což v praxi znamená, že během ochlazování prochází slitina fází, kdy je část materiálu již pevná a část zůstává kapalná.
Důležité je také to, jak se čte složení fází při dané teplotě. To se provádí nakreslením vodorovné čáry (izotermy) přes graf: průsečík s liquidem ukazuje složení kapaliny a průsečík se solidem ukazuje složení pevné fáze v rovnováze při dané teplotě. To je základ pro odvození toho, co se ve skutečnosti děje ve slitině během ochlazování.
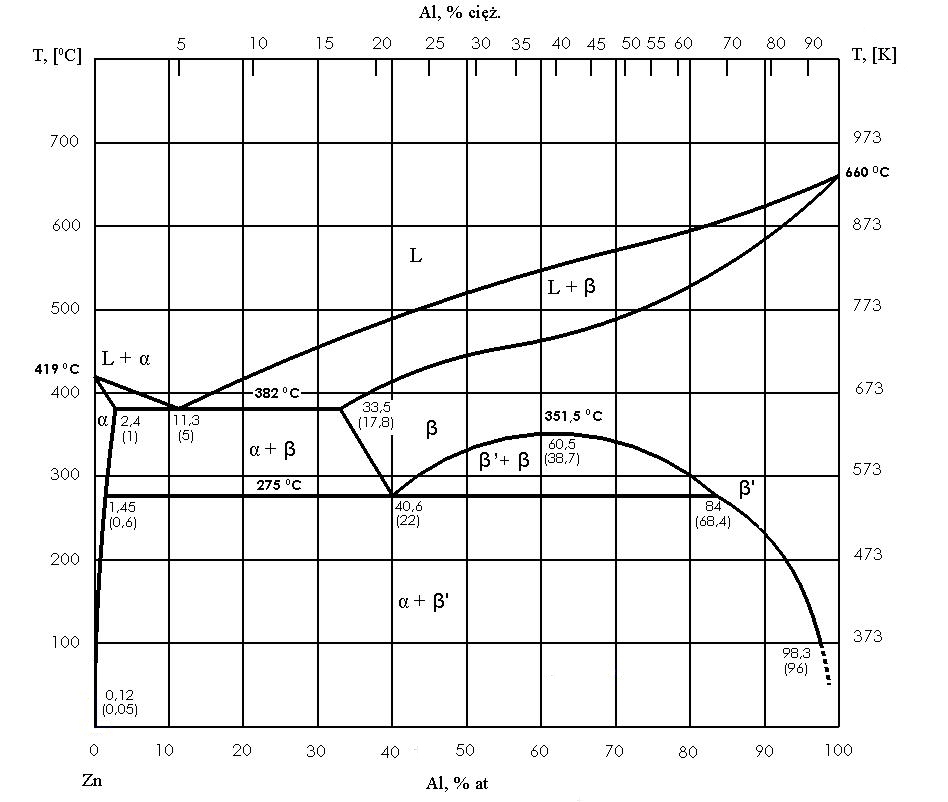
Nejdůležitější typy rovnovážných systémů
Kontinuální pevné řešení
V některých systémech se složky volně mísí jak v kapalném, tak v pevném stavu. V tomto případě existuje pod solidem jedna fáze – pevný roztok se složením závislým na poloze na ose složení. Během ochlazování začíná slitina tuhnout při teplotě liquidus, kdy se objeví první krystaly pevného roztoku, a končí při teplotě solidus, kdy zmizí poslední část kapaliny. Jedná se o klasický příklad tuhnutí v teplotním rozmezí bez jediného zastavení.
Stojí za zmínku, že v oblasti „kapalného + pevného roztoku“ se složení obou fází liší a mění se s teplotou. Čtení izotermy nám umožňuje určit, která část slitiny je v daném okamžiku již v pevném stavu a která část je stále kapalná.
Eutektikum
Eutektický systém je velmi charakteristický, když se složky mísí v kapalném stavu, ale v pevném stavu se rozpouštějí špatně nebo vůbec. V tomto případě existuje eutektické složení a teplota, při které se homogenní kapalina přemění na dvě pevné fáze najednou. Taková přeměna je izotermická, takže na chladicí křivce dochází k jasné pauze, jako v případě čistého kovu, ale mechanismus je odlišný: místo jedné pevné fáze se vytvoří jemná směs dvou fází, obvykle se specifickou, pravidelnou morfologií.
Slitiny s jiným složením než eutektickým tvoří smíšenou strukturu. Pokud je slitina hypereutektická, nejprve se oddělí primární krystaly jedné fáze a teprve poté zbytek kapaliny ztuhne jako eutektikum. Pokud je slitina hypereutektická, nejprve se objeví primární krystaly druhé fáze a poté eutektikum. V důsledku toho mikrostruktura závisí na složení: může převládat eutektikum, mohou převládat primární krystaly nebo mohou mít obě složky podobné poměry.
Eutektikum s omezenou rozpustností v pevném stavu
V praxi se často vyskytuje přechodná situace: složky se v kapalném stavu dobře mísí, ale v pevném stavu tvoří pevné roztoky pouze v omezené míře. Namísto „čistých“ fází se pak tvoří pevné mezní roztoky, běžně označované jako α a β, a eutektikum se stává směsí těchto dvou roztoků s nasyceným složením při eutektické teplotě.
To je velmi důležité, protože s dalším ochlazováním se rozpustnost v pevném stavu často snižuje, takže roztoky α a β se mohou stát přesycenými. V důsledku toho může po dokončení tuhnutí dojít k sekundárnímu oddělení a dalšímu „zrání“ struktury. Diagram proto není pouze popisem krystalizace, ale také průvodcem změnami v pevném stavu, které ovlivňují vlastnosti materiálu.
Peritektika
V peritektických systémech dochází k transformaci, při které kapalina reaguje s existující pevnou fází a vytváří novou pevnou fázi. K tomu dochází při určité teplotě, protože v okamžiku reakce koexistují tři fáze. Peritektický mechanismus má praktický význam, protože nová fáze často roste na krystalech původní fáze a vytváří vrstvu, která brání další difúzi složek. To může způsobit, že skutečný průběh transformace se odchýlí od ideální rovnováhy, zejména při rychlejším ochlazování.
Z technologického hlediska může peritektika být zdrojem heterogenity a struktur, které závisí nejen na samotném rovnovážném diagramu, ale také na kinetice, tj. rychlosti difúzních procesů. Při interpretaci diagramů je proto důležité mít na paměti, že diagram popisuje rovnovážný stav a ne vždy skutečný stav „za běhu“, kdy není čas na vyrovnání složení.
Omezená rozpustnost v kapalinách
Někdy, i v kapalném stavu, není systém zcela homogenní. Může se stát, že v určitém teplotním rozmezí se kapalina rozdělí na dvě kapaliny s odlišným složením, což podporuje segregaci a tvorbu oblastí s odlišnými vlastnostmi. V takovém systému je možná monotektická transformace, při které se jedna kapalina přemění na jinou kapalinu a pevnou fázi.
Z hlediska technologie odlévání je to důležité, protože oddělení kapalin může vést k nežádoucí heterogenitě slitiny. V praxi se tomu často předchází vhodnou kontrolou procesu, včetně volby rychlosti ochlazování nebo způsobu míchání tekutého kovu, aby se omezila doba, během níž dochází k segregaci.
Chemické sloučeniny a intermetalické fáze
V mnoha systémech se tvoří chemické sloučeniny a intermetalické fáze. Pokud má sloučenina konstantní stechiometrické složení, objeví se v diagramu jako charakteristická poloha odpovídající tomuto poměru složek. Taková sloučenina se může tavit „jako čistý kov“, když se přemění na kapalinu stejného složení, nebo se může tvořit a mizet v peritektických přeměnách, když proces probíhá reakcí s kapalinou.
Intermetalické fáze jsou často tvrdé a křehké a jejich přítomnost může výrazně změnit vlastnosti slitiny. Z tohoto důvodu jsou fázové diagramy zvláště důležité při navrhování slitin, protože nám umožňují předpovědět, zda se v daném rozsahu složení a teploty objeví fáze, která zhorší plasticitu, nebo naopak posílí slitinu prostřednictvím jemných precipitátů.
Transformace pevných látek: eutektoidní a peritektoidní
Rovnovážné diagramy nekončí tuhnutím. U mnoha slitin jsou důležité transformace, ke kterým dochází po přechodu do pevného stavu, zejména pokud se rozpustnost v pevných roztocích mění s teplotou nebo pokud jedna ze složek vykazuje polymorfismus. Zvláště důležitá je eutektoidní transformace, která je ekvivalentní eutektikům, ale probíhá zcela v pevném stavu: jedna pevná roztok se rozpadá na dvě pevné fáze při konstantní teplotě. Tato transformace často vede k jemné, pravidelné struktuře a může významně změnit mechanické vlastnosti.
Existuje také peritektická transformace, analogická k peritektice, ale bez účasti kapaliny: dvě pevné fáze reagují a vytvářejí třetí pevnou fázi. V praxi mohou být transformace v pevném stavu rozhodující, protože mohou určovat tvrdost, rázovou pevnost nebo odolnost proti tečení, i když proces tuhnutí proběhl správně.
Praktický význam
Nejdůležitějším závěrem z analýzy diagramů je, že vlastnosti slitin vyplývají především z jejich struktury, a nikoli pouze z prvků, které obsahují. Jednofázové slitiny jsou obvykle homogennější a jejich vlastnosti se často mění plynuleji s měnícím se složením. U vícefázových slitin je situace složitější, protože chování materiálu je určeno typem fází, jejich poměrem, rozložením, velikostí zrn a morfologií (např. formou eutektik nebo povahou precipitátů).
Fázový diagram je tedy nástroj, který pomáhá propojit podmínky procesu s výsledkem. Pokud víte, při jakých teplotách a složeních se určité fáze vyskytují, můžete vědomě vybrat složení slitiny a podmínky chlazení a tepelného zpracování. V praxi to znamená, že je možné předpovědět, zda bude slitina mít sklon k segregaci, zda se objeví křehké intermetalické fáze, zda lze sraženiny použít k posílení nebo zda bude struktura stabilní za provozních podmínek.
Fázové rovnovážné systémy slitin – shrnutí
Fázové rovnovážné systémy jsou nástrojem, který systematicky a předvídatelně organizuje chování slitin. Lze je použít k určení které fáze budou stabilní, kdy začne a skončí tuhnutí, zda dojde k eutektickým nebo peritektickým jevům a jaké přeměny mohou nastat v pevném stavu. V praxi to znamená schopnost kontrolovat mikrostrukturu a tím i mechanické a fyzikální vlastnosti materiálu. Schopnost číst fázové diagramy je proto jednou z nejdůležitějších dovedností v materiálových vědách a metalurgii, protože umožňuje převést teorii fázových transformací do reálných technických rozhodnutí.