Metalen biomaterialen

Inhoudsopgave
Metalen spelen een heel andere rol in biomedische techniek dan keramiek of polymeren. Ze onderscheiden zich vooral door hun uitstekende mechanische eigenschappen en hoge elektrische en thermische geleidbaarheid. Dit komt door de aard van de metaalbinding: sommige elektronen zijn gedelokaliseerd en vormen een wolk van ‘vrije elektronen’ die verantwoordelijk zijn voor de geleidbaarheid en voor de sterke, zij het niet-directionele binding tussen metaalionen. Deze structuur stelt atomen in het kristalrooster in staat om ten opzichte van elkaar te bewegen zonder de orde te verstoren, wat resulteert in de plasticiteit die kenmerkend is voor metalen en het vermogen om grote vervormingen te ondergaan zonder plotselinge vernietiging.
Deze eigenschap wordt heel bewust gebruikt in biomaterialen. Metalen dienen zowel als passieve vervanging voor hard weefsel – in heup- en knieprothesen, botplaten, schroeven, intramedullaire nagels, tandheelkundige implantaten – als materiaal voor meer ‘actieve’ hulpmiddelen zoals vasculaire stents, kathetergeleiders, orthodontische draden en cochleaire implantaten. Bij deze toepassingen is niet alleen sterkte van belang, maar ook vervormbaarheid, elasticiteit, geleidbaarheid en geschiktheid voor precisieproductie.
De geschiedenis van metalen biomaterialen begon met staallegeringen. De eerste legering die speciaal voor orthopedische toepassingen werd ontwikkeld, was vanadiumstaal, dat werd gebruikt voor de productie van platen en schroeven voor het fixeren van breuken (bekend als Sherman-platen). Na verloop van tijd werd dit vervangen door roestvrij staal en later door kobalt- en chroomlegeringen en titaniumlegeringen. Deze legeringen maken gebruik van een aantal metalen – ijzer (Fe), chroom (Cr), kobalt (Co), nikkel (Ni), titanium (Ti), tantaal (Ta), niobium (Nb), molybdeen (Mo) en wolfraam (W) – die in grotere doses giftig zijn voor het lichaam, maar in de vorm van stabiele, corrosiebestendige legeringen goed worden verdragen.
De belangrijkste uitdaging bij het gebruik van metalen is corrosie in de in vivo-omgeving. Corrosieproducten kunnen leiden tot zowel verzwakking van het implantaat zelf als tot ongewenste biologische reacties – lokale ontstekingen, verkleuring van weefsels, orgaanschade of immuunreacties. Daarom richt de moderne techniek van metalen biomaterialen zich op legeringen die in staat zijn om duurzame, passieve beschermende lagen op het oppervlak te vormen en op bewuste oppervlaktebewerking om een goede sterkte, hoge corrosiebestendigheid en een passende biologische reactie te combineren.
Roestvrij staal als implantaatmateriaal
Roestvrij staal was een van de eerste materialen die met succes vanadiumstaal in implantaten verving. Aanvankelijk werd 18-8 staal (type 302) gebruikt, dat ongeveer 18% chroom en 8% nikkel bevatte en een aanzienlijk betere corrosiebestendigheid had dan klassiek koolstofstaal. Na verloop van tijd verscheen een variant van 18-8 met toevoeging van molybdeen (18-8sMo), tegenwoordig bekend als 316-staal, gevolgd door een modificatie met een lager koolstofgehalte: 316L-staal. Door het koolstofgehalte te verlagen van ongeveer 0,08% tot maximaal 0,03% wordt de neiging tot vorming van chroomcarbiden aan korrelgrenzen verminderd, wat de corrosiebestendigheid in chloride-rijke omgevingen zoals lichaamsvloeistoffen verbetert.
Chroom is primair verantwoordelijk voor de corrosiebestendigheid van roestvast staal. Zelfs met een Cr-gehalte van 11% vormt zich een dunne beschermende oxidelaag op het oppervlak, waardoor het staal een zogenaamde passieve toestand krijgt. De toevoeging van molybdeen verhoogt de weerstand tegen putcorrosie in chlorideomgevingen, waardoor 316/316L-staal geschikter is voor fysiologische omstandigheden. Nikkel stabiliseert op zijn beurt de austenitische fase (γ, fcc-structuur) bij kamertemperatuur, waardoor het materiaal niet-magnetisch wordt en de corrosiebestendigheid verbetert.
Austenitisch staal kan niet worden gehard door middel van conventionele warmtebehandeling, maar reageert zeer goed op koudvervorming. Hierdoor kan een breed scala aan mechanische eigenschappen worden aangepast – van meer ductiele, zachte structuren tot aanzienlijk geharde structuren met een hoge treksterkte. Mechanische gegevens voor 316L-staal tonen aan dat, afhankelijk van de mate van koude vervorming, verschillende combinaties van sterkte en ductiliteit kunnen worden bereikt, wat belangrijk is om het materiaal af te stemmen op de specifieke functie van het implantaat.
Ondanks hun vele voordelen zijn 316- en 316L-staalsoorten geen ideale materialen. Onder hoge spanningsomstandigheden, vooral in gebieden met beperkte zuurstoftoegang, zoals rond schroefdraden of botplaatverbindingen, kan spleet- en putcorrosie optreden en op lange termijn kan ook vermoeidheidscorrosie optreden. Om deze reden worden roestvast staalsoorten meestal gebruikt in tijdelijke implantaten zoals platen, schroeven, spijkers en fixatiedraden, die kunnen worden verwijderd zodra het bot is genezen. Om hun eigenschappen te verbeteren, worden oppervlaktebewerkingen op grote schaal toegepast – van polijsten en passiveren in salpeterzuur tot anodiseren of stikstofimplantatie door middel van gloedontlading, waardoor de weerstand tegen corrosie, slijtage en vermoeidheid wordt verhoogd.
Kobalt- en chroomlegeringen
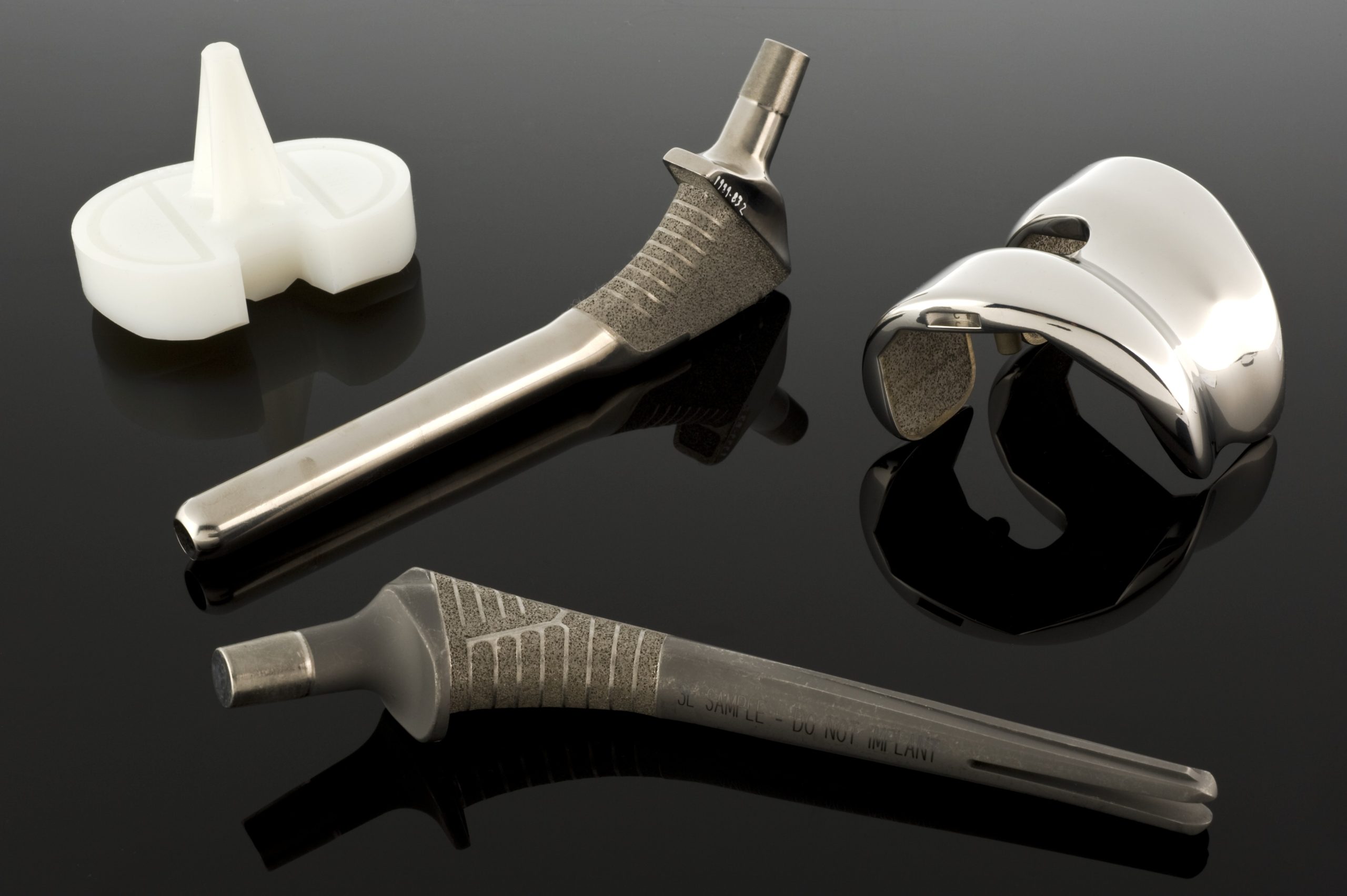
Wanneer mechanische vereisten de mogelijkheden van roestvrij staal overstijgen, komen kobalt- en chroomlegeringen in beeld. Er zijn twee hoofdgroepen van dergelijke legeringen in biomaterialen: gegoten CoCrMo-legering, die onder andere wordt gebruikt in endoprothese-cups en -koppen, en gesmede CoNiCrMo-legering, die wordt gebruikt in onderdelen die aan hoge belastingen worden blootgesteld, zoals heup- of knieprothesestelen. ASTM-normen beschrijven verschillende versies van dergelijke materialen (F75, F90, F562, F563), maar in de klinische praktijk domineren CoCrMo en CoNiCrMo.
Kobalt en chroom vormen een vaste oplossing tot ongeveer 65% Co, en de toevoeging van molybdeen zorgt voor korrelverfijning en, als gevolg daarvan, een hogere sterkte na gieten of smeden. Chroom speelt een dubbele rol: het verhoogt de corrosiebestendigheid door een passieve oxidelaag te vormen en draagt bij aan de versterking van de oplossing. In de klinische praktijk worden Co-Cr-legeringen gekenmerkt door een zeer hoge elasticiteitsmodulus – in het bereik van 220-234 GPa, hoger dan roestvrij staal, en een zeer goede slijtvastheid.
Deze hoge stijfheid heeft echter ook gevolgen. Een implantaat dat te stijf is, kan te veel van de belasting op zich nemen, wat leidt tot stress shielding – een vermindering van de belasting op het eigen bot van de patiënt en de geleidelijke resorptie ervan. Hoewel de klinische betekenis van dit effect niet helemaal duidelijk is, is het een belangrijke factor bij het ontwerp en de vorm van prothetische stelen. Aan de andere kant maken hardheid en slijtvastheid kobalt- en chroomlegeringen een uitstekende keuze voor ‘metaal-metaal’-wrijvingsparen, waarbij het minimaliseren van slijtage op lange termijn cruciaal is. Studies naar langdurig gebruikte endoprothesen met dergelijke paren wijzen op een zeer lage lineaire slijtage, in de orde van enkele micrometers per jaar.
Een ander belangrijk punt is het vrijkomen van ionen uit Co-Cr-legeringen en hun mogelijke toxiciteit. Experimenten in Ringer-oplossing hebben aangetoond dat de snelheid waarmee nikkel vrijkomt uit CoNiCrMo-legering en 316L-staal na een bepaalde periode zeer vergelijkbaar is, ook al bevat de kobaltlegering ongeveer drie keer meer nikkel. In-vitro-onderzoeken hebben aangetoond dat kobaltdeeltjes toxisch kunnen zijn voor botopbouwende cellen, terwijl chroom- en Co-Cr-legeringsdeeltjes veel beter worden verdragen. Hoge concentraties Co- en Ni-ionextracten verstoren duidelijk het celmetabolisme in culturen, terwijl chroomionen een lagere toxiciteit vertonen.
Titanium en zijn legeringen
Van alle metalen die als biomateriaal worden gebruikt, neemt titanium een bijzondere plaats in. In de elektrochemische reeks is het een ‘actief’ element, maar in een fysiologische omgeving is het bedekt met een zeer stabiele, passieve oxidelaag, waardoor de corrosiestroom in fysiologische oplossingen extreem laag is, in de orde van 10⁻⁸ A/cm². In de praktijk blijven titaniumimplantaten na een lange periode in het lichaam visueel onveranderd.
Zuiver titanium (cp-Ti) en de meest populaire Ti–6Al–4V-legering combineren een zeer goede corrosiebestendigheid met een gunstige sterkte-gewichtsverhouding. Hun elasticiteitsmodulus is lager dan die van staal of Co–Cr-legeringen, waardoor ze dichter bij botten liggen en het risico op stress shielding mogelijk verminderen. Aan de andere kant is titanium niet zo stijf of sterk onder spanning als de beste staalsoorten of kobaltlegeringen, waardoor het ontwerp van dragende elementen een nauwkeurige spanningsanalyse en vaak een grotere doorsnede vereist.
In de afgelopen decennia zijn ook titaniumlegeringen met een lagere elasticiteitsmodulus en een hogere corrosiebestendigheid ontwikkeld, die onder andere Nb en Zr bevatten, bijvoorbeeld Ti–13Nb–13Zr, speciaal ontworpen voor gewrichtsprothesen. Daarnaast is oppervlakteverharding van Ti-legeringen (bijvoorbeeld thermochemische behandeling, nitreren) ontwikkeld, waardoor een goede biocompatibiliteit van het substraat kan worden gecombineerd met een hoge slijtvastheid in wrijvingszones.
Nikkel-titanium (NiTi) legeringen, die vormgeheugen en superelasticiteit vertonen, vormen een speciale groep. Dankzij martensitische transformatie kunnen ze een eerder vastgelegde vorm reproduceren wanneer ze boven de transformatietemperatuur worden verwarmd, of vertonen ze een zeer hoge elastische vervormbaarheid in een smal spanningsbereik. Deze eigenschap wordt onder andere gebruikt in vasculaire stents, orthodontische bogen en kathetergeleiders, waardoor atraumatische inbrenging van hulpmiddelen en hun stabiele expansie na dilatatie mogelijk is.
In het geval van titanium zijn de oppervlakte-eigenschappen bijzonder belangrijk. Studies tonen aan dat zowel de ruwheid als de oppervlaktechemie het gedrag van osteoblasten en botvormende cellen reguleren – ze beïnvloeden de hechting, proliferatie en de productie van groeifactoren en cytokines. Door een geschikte chemische behandeling van het oppervlak van Ti en zijn legeringen kunnen deze bioactief worden, d.w.z. in staat om een apatietlaag te vormen bij contact met lichaamsvloeistoffen, wat een directe binding met het bot bevordert.

Metalen in de tandheelkunde en andere speciale toepassingen
Zowel edelmetalen als onedele metalen worden gebruikt in de tandheelkunde. Goud is vrijwel corrosiebestendig (immuniteitstype weerstand) en biedt uitstekende duurzaamheid en chemische stabiliteit in prothetische reconstructies. De beperkingen zijn echter de hoge dichtheid, onvoldoende sterkte voor zware belastingen en de kosten, waardoor het vrijwel niet wordt gebruikt in de orthopedie.
Tandamalgaam, een legering van zilver, tin en kwik, wordt veel gebruikt. Hoewel de afzonderlijke fasen van dit materiaal bij een neutrale pH passief zijn, corrodeert amalgaam in de praktijk vaak, vooral bij beluchtingsverschillen onder de bacteriële tandplak en lokale galvanische microcellen. Het is in feite het meest corrosiegevoelige materiaal dat in de tandheelkunde wordt gebruikt, wat zich uit in verkleuring en de vorming van corrosieproducten op het oppervlak van vullingen.
Tot de groep van speciale metalen behoren ook platinametalen en hun legeringen, die worden gebruikt wanneer chemische bestendigheid en geleidbaarheidscontrole cruciaal zijn, evenals Ni-Cu-legeringen en andere systemen die worden gebruikt bij hyperthermie – het opzettelijk verwarmen van kankerweefsel met behulp van een geïnduceerd magnetisch veld. Dit soort legeringen is zo ontworpen dat hun thermische reactie in een elektromagnetisch veld goed kan worden geregeld, waardoor de warmte-energie nauwkeurig aan de tumor kan worden afgegeven.
Corrosie van metalen implantaten in een biologische omgeving
Corrosie is een centraal fenomeen voor metalen biomaterialen. In het lichaam hebben we te maken met een elektrolytische vloeistof die ionen (Na⁺, Cl⁻, HCO₃⁻, fosfaten) bevat, een variabele pH en potentiaalverschillen tussen verschillende gebieden – al deze factoren bevorderen elektrochemische reacties.
Pourbaix-diagrammen, die de relatie tussen elektrochemisch potentieel en pH weergeven, worden gebruikt om de stabiliteit van metalen te beschrijven. Ze maken onderscheid tussen gebieden met corrosie (activiteit), passiviteit en immuniteit. In het menselijk lichaam hebben verschillende vloeistoffen verschillende pH- en zuurstofniveaus: weefselvloeistof heeft meestal een pH van ongeveer 7,4, maar in de buurt van een wond kan deze dalen tot 3,5 en in een geïnfecteerde wond kan deze stijgen tot 9,0. Dit betekent dat een metaal dat in het ene deel van het lichaam goed presteert, in een ander deel kan corroderen.
Pourbaix-diagrammen hebben echter hun beperkingen: ze zijn gebaseerd op evenwichtstoestanden in een eenvoudig systeem van metaal, water en reactieproducten. De aanwezigheid van chloride-ionen of complexe organische moleculen kan het gedrag van het metaal aanzienlijk veranderen, waardoor de voorspelde passiviteit in de praktijk te optimistisch kan blijken te zijn. Daarom worden naast deze diagrammen ook polarisatiecurves gebruikt, waarmee de corrosiestroom kan worden bepaald en op basis daarvan het aantal ionen dat in de weefsels vrijkomt en de snelheid van materiaalverlies kan worden berekend. Als alternatief wordt het verlies aan monstermassa tijdens blootstelling in een oplossing die vergelijkbaar is met lichaamsvloeistof gemeten.
Corrosie van implantaatmaterialen kan verschillende vormen aannemen. Uniforme corrosie leidt tot relatief homogeen materiaalverlies, maar lokale vormen zijn veel gevaarlijker. Putcorrosie veroorzaakt diepe, lokale verliezen – roestvrij staal is hier bijzonder gevoelig voor in aanwezigheid van chloriden. Spleetcorrosie treedt op in gebieden met beperkte toegang tot zuurstof, zoals de openingen tussen de schroef en de plaat, waar de lokale chemische omstandigheden (pH, ionenconcentratie) aanzienlijk verschillen van de omgeving. Wrijvingscorrosie is corrosie die gepaard gaat met microbewegingen van twee contactoppervlakken – mechanische slijtage vernietigt de passieve laag, waardoor vers metaal wordt blootgesteld en corrosie wordt versneld.
Spanningscorrosie en vermoeidheidscorrosie zijn speciale vormen van corrosie. Bij mechanische spanningen, vooral bij herhaalde spanningen, kan de corrosiesnelheid toenemen en kunnen microscheurtjes zich sneller verspreiden. Bij implantaten van roestvrij staal zijn bijvoorbeeld breuken van heupnagels en -pennen waargenomen wanneer buigbelastingen en een agressieve fysiologische omgeving tegelijkertijd aanwezig waren. In dergelijke gevallen is het moeilijk om te spreken van ‘pure’ corrosie – het is altijd een dynamische interactie van chemie, mechanica en microstructuur.
Verschillende metalen gedragen zich in dit opzicht verschillend. Edelmetalen, zoals goud, zijn vrijwel corrosiebestendig – hun standaard elektrochemisch potentieel is positief en in Pourbaix-diagrammen bevinden ze zich in het immuniteitsgebied. Titanium en Co-Cr-legeringen zijn gebaseerd op passiviteit – ze vormen een goed hechtende, dichte oxidelaag, waardoor hun corrosiestromen zeer laag zijn en het oppervlak stabiel blijft. Roestvast staal profiteert ook van de passiviteit van chroom, maar hun passieve laag is minder stabiel, waardoor ze gevoeliger zijn voor putcorrosie en spleetcorrosie. Tandamalgaam daarentegen is, hoewel thermodynamisch gedeeltelijk passief, in de praktijk een materiaal dat zeer gevoelig is voor corrosie, vooral in aanwezigheid van biofilm.
Productie en verwerking van metalen implantaten
Bij de productie van metalen implantaten gaat het niet alleen om het vormgeven van de geometrie, maar ook om het beheersen van de microstructuur en de oppervlakteconditie, die bepalend zijn voor de vermoeiingssterkte, corrosiebestendigheid en biologische reactie.
Bij roestvast staal is het van cruciaal belang dat austenitisch staal zeer snel hard wordt onder druk. Dit betekent dat tijdens koudvervorming (walsen, trekken, buigen) de sterkte toeneemt, maar tegelijkertijd de plasticiteit afneemt. Om het vereiste niveau van vervormbaarheid te herstellen, wordt tussentijdse gloeien toegepast, waarbij temperaturen en tijden die bevorderlijk zijn voor de precipitatie van chroomcarbiden aan de korrelgrenzen, die de corrosiebestendigheid verzwakken, moeten worden vermeden. Na het vormen worden de componenten gereinigd, gedeoxideerd (chemisch of abrasief) en gepassiveerd, meestal in een salpeterzuuroplossing volgens ASTM F86.
Co-Cr-legeringen gedragen zich anders: ze zijn zeer gevoelig voor versterking tijdens vervorming, wat in veel gevallen conventioneel smeden bemoeilijkt. Daarom worden onderdelen met complexe geometrieën, zoals prothesekoppen en -kommen, vaak vervaardigd met behulp van precisiegieten (de zogenaamde verlorenwasmethode). Het proces omvat het vervaardigen van een nauwkeurig wasmodel, het bedekken ervan met vuurvast materiaal, het uitbranden van de was en het gieten van vloeibare Co-CrMo-legering in de mal bij hoge temperatuur. De temperatuur van de mal en de afkoeltijd zijn van invloed op de korrelgrootte en de grootte en verdeling van de carbiden – een fijne microstructuur verhoogt de sterkte maar kan de weerstand tegen brosse breuken verminderen, terwijl grotere korrels en carbiden de ductiliteit verbeteren ten koste van de sterkte. De ontwerper moet daarom een compromis vinden tussen sterkte en breukweerstand.
Voor titaniumlegeringen zijn giet-, smeed- en warmtebehandelingsprocessen, evenals oppervlaktebehandeling, van cruciaal belang. Titanium vereist een beschermende atmosfeer tijdens verwerking bij hoge temperaturen, omdat het gemakkelijk reageert met zuurstof en stikstof en zo broze oppervlaktelagen vormt. Na de eerste mechanische bewerking worden de oppervlakken van titaniumimplantaten gezandstraald, geëtst met zuur, geanodiseerd of een combinatie van deze processen, wat resulteert in een gunstige micrometerruwheid en een gewijzigde oxidelaag. Studies tonen aan dat op deze manier geprepareerde oppervlakken een snellere botingroei en de vorming van een sterke mechanische en mogelijk chemische binding bevorderen.
De productieprocessen van vormgeheugenlegeringen vormen een aparte categorie. In hun geval is een nauwkeurige controle van de chemische samenstelling en de warmtebehandeling, die bepalend zijn voor de martensitische transformatietemperaturen en het bereik van superelasticiteit, van cruciaal belang. NiTi-stents of orthodontische bogen moeten de gewenste vervorming bereiken en terugkeren naar hun oorspronkelijke vorm binnen een strikt gedefinieerd temperatuurbereik, inclusief fysiologische omstandigheden.
Samenvatting – Metalen biomaterialen
Metalen biomaterialen vormen een uitgebreide familie, waarin elk materiaal zijn eigen, vrij nauwkeurig gedefinieerde functionele niche inneemt. Roestvrij staal, met name type 316L, is een relatief goedkoop en gemakkelijk te verwerken materiaal met goede mechanische eigenschappen en voldoende corrosiebestendigheid. Daarom wordt het voornamelijk gebruikt in tijdelijke implantaten en minder kritische componenten. Co-Cr-legeringen bieden een zeer hoge sterkte, hardheid en slijtvastheid, waardoor ze het materiaal bij uitstek zijn voor prothetische cups en koppen, maar ook voor stelen, waar duurzaamheid onder zware belasting belangrijk is. Titanium en zijn legeringen, die een zeer goede corrosiebestendigheid, gunstige elasticiteitsmodulus en hoge biocompatibiliteit combineren, zijn de ‘gouden standaard’ geworden voor langdurige implantaten, vooral in de orthopedie en tandheelkundige implantologie.
Speciale legeringen, zoals NiTi met vormgeheugen, spelen ook een belangrijke rol en maken volledig nieuwe therapeutische strategieën mogelijk – van zelfexpanderende stents tot superelastische orthodontische bogen. Goud en amalgaam blijven belangrijk in de tandheelkunde, hoewel hun toepassingen worden herzien in het licht van esthetische en veiligheidseisen.
De gemeenschappelijke noemer voor alle metalen biomaterialen is de noodzaak om corrosie en weefselinteractie te beheersen. Pourbaix-diagrammen, polarisatiecurves, vermoeidheidstests en ionentoxiciteitsstudies vormen de basis voor het technisch ontwerp van deze materialen. Oppervlaktebehandeling is even belangrijk – deze bepaalt de kwaliteit van de passieve laag, de slijtvastheid, de celhechting en de aard van de verbinding met het bot.
Als gevolg daarvan bekijkt de moderne biomaterialen-engineering metalen niet meer afzonderlijk, maar behandelt ze als onderdeel van complexe systemen: een metalen kern kan worden bekleed met bioactieve keramiek, omgeven door een polymeercomposiet, of werken met poreuze keramische structuren die regeneratie ondersteunen. Metalen bieden draagvermogen en plasticiteit, keramiek biedt bioactiviteit en slijtvastheid, en polymeren bieden flexibiliteit en de mogelijkheid om zachte structuren te vormen. Samen vormen ze de basis van de moderne implantologie, waar het doel niet langer alleen is om ‘onderdelen te vervangen’, maar om functionele, biologisch geïntegreerde orgaanreconstructie te bereiken.