Układy równowagi fazowej stopów
Spis treści
W metalach czystych przebieg przemian jest zazwyczaj łatwy do uchwycenia: topnienie i krzepnięcie zachodzą w jednej, ściśle określonej temperaturze, podobnie jak niektóre przemiany strukturalne w stanie stałym. Na krzywych chłodzenia widać wtedy charakterystyczne przystanki, bo energia jest pochłaniana lub oddawana na samą przemianę, a nie na zmianę temperatury. W przypadku stopów sytuacja przestaje być tak „punktowa”. Często dzieje się tak, że stop zaczyna krzepnąć w jednej temperaturze, ale kończy w innej, a w trakcie procesu współistnieją fazy o zmieniającym się składzie.
Właśnie dlatego w materiałoznawstwie stosuje się wykresy układów równowagi fazowej, nazywane też diagramami fazowymi. Taki wykres można traktować jak mapę: pokazuje on, jakie fazy są stabilne w zależności od temperatury i składu oraz w jakiej kolejności pojawiają się przemiany podczas nagrzewania i chłodzenia. Dzięki temu można przewidywać zarówno przebieg krystalizacji, jak i późniejsze przemiany w stanie stałym, a w konsekwencji – strukturę oraz właściwości gotowego stopu.
Kluczowe pojęcia: układ, faza i składniki
Żeby poprawnie czytać wykresy równowagi, trzeba rozumieć język, którym one „mówią”. W ujęciu termodynamicznym układ to wydzielony fragment rzeczywistości analizowany w danych warunkach, na przykład próbka stopu, którą chłodzimy. Faza oznacza jednorodną część układu o jednakowych właściwościach i stałym składzie chemicznym, oddzieloną od innych faz powierzchnią rozdziału. Faza może być cieczą, może być też roztworem stałym lub konkretną fazą międzymetaliczną, jeśli taka powstaje.
Ważne są również składniki, czyli substancje (najczęściej pierwiastki), które tworzą stop i z których mogą powstawać fazy. W kontekście wykresów dwuskładnikowych mówimy zwykle o układzie złożonym z dwóch składników, których proporcje zmieniają się w stopie. W praktyce oznacza to, że wykres nie opisuje jednego „materiału”, tylko całą rodzinę stopów o różnych składach, a każda zmiana składu przesuwa nas w inne miejsce mapy fazowej.
Reguła faz Gibbsa
Jednym z powodów, dla których zachowanie stopów różni się od zachowania metali czystych, jest liczba zmiennych, które „sterują” układem. Reguła faz Gibbsa porządkuje relację między liczbą składników, liczbą faz oraz liczbą stopni swobody. W praktyce metalurgicznej często zakłada się stałe ciśnienie, ponieważ jego wpływ na przemiany fazowe metali jest zwykle niewielki w porównaniu z wpływem temperatury i składu.
Sens praktyczny jest taki: jeśli układ ma mało „miejsca na manewr”, to przemiana musi zajść w jednej temperaturze (stąd charakterystyczne przystanki). Gdy jednak dochodzi zmienność składu i możliwość współistnienia kilku faz, układ może przechodzić przez obszary, w których występują dwie fazy jednocześnie, a ich składy zmieniają się wraz z temperaturą. Wtedy krzepnięcie czy przemiany w stanie stałym rozciągają się na pewny przedział temperatur, a struktura powstaje etapami.
Jak powstaje wykres równowagi dwuskładnikowej?
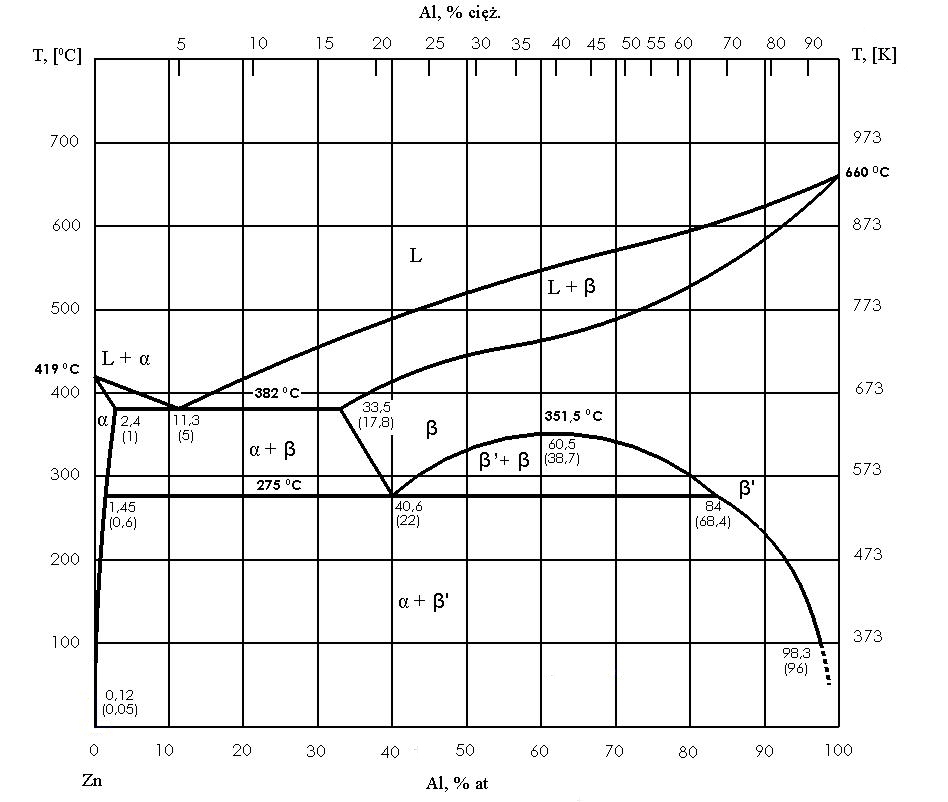
Typowy diagram dwuskładnikowy przedstawia zależność pomiędzy temperaturą a składem chemicznym. Na osi poziomej odkłada się skład stopu (np. procent jednego składnika), a na osi pionowej temperaturę. Żeby taki wykres zbudować, wykonuje się serię doświadczeń dla wielu stopów o różnych proporcjach składników i rejestruje się temperatury, w których zachodzą przemiany – najczęściej metodami analizy termicznej, na podstawie krzywych chłodzenia i nagrzewania.
Na wykresie szczególnie ważne są granice obszarów fazowych. Linia zwana likwidusem oddziela obszar całkowicie ciekły od obszaru, gdzie ciecz współistnieje z fazą stałą. Linia solidusu wyznacza granicę, poniżej której stop jest całkowicie stały. Między likwidusem a solidusem najczęściej występuje obszar mieszaniny (np. ciecz + faza stała), co w praktyce oznacza, że podczas chłodzenia stop przechodzi przez etap, w którym część materiału już jest stała, a część nadal pozostaje ciekła.
Ważne jest też, jak odczytuje się skład faz w danej temperaturze. Robi się to, prowadząc przez wykres poziomą linię (izotermę): przecięcie z likwidusem pokazuje skład cieczy, a przecięcie z solidusem skład fazy stałej w równowadze w tej temperaturze. To podstawa do wnioskowania o tym, co realnie dzieje się w stopie podczas chłodzenia.
Najważniejsze typy układów równowagi
Roztwór stały ciągły
W niektórych układach składniki mieszają się w sobie bez ograniczeń zarówno w cieczy, jak i w stanie stałym. W takim przypadku poniżej solidusu występuje jedna faza – roztwór stały o składzie zależnym od położenia na osi składu. Podczas chłodzenia stop zaczyna krzepnąć na likwidusie, gdy pojawiają się pierwsze kryształy roztworu stałego, a kończy na solidusie, kiedy znika ostatnia porcja cieczy. To klasyczny przykład krzepnięcia w zakresie temperatur, bez pojedynczego przystanku.
Warto podkreślić, że w obszarze „ciecz + roztwór stały” składy obu faz są różne i zmieniają się wraz z temperaturą. Odczyt izotermy pozwala ustalić, jaka część stopu w danej chwili jest już w postaci stałej, a jaka nadal jest ciekła.
Eutektyka
Bardzo charakterystyczny jest układ eutektyczny, gdy składniki mieszają się w cieczy, ale w stanie stałym rozpuszczają się słabo albo wcale. Wówczas istnieje skład i temperatura eutektyczna, w których jednorodna ciecz przechodzi w dwie fazy stałe naraz. Taka przemiana jest izotermiczna, więc na krzywej chłodzenia pojawia się wyraźny przystanek, podobnie jak w przypadku metalu czystego, ale mechanizm jest inny: zamiast jednej fazy stałej powstaje drobna mieszanina dwóch faz, zwykle o specyficznej, regularnej morfologii.
Stopy o składzie innym niż eutektyczny tworzą strukturę mieszaną. Jeśli stop jest podeutektyczny, najpierw wydzielają się kryształy pierwotne jednej fazy, a dopiero reszta cieczy krzepnie jako eutektyka. Jeśli stop jest nadeutektyczny, analogicznie pojawiają się kryształy pierwotne drugiej fazy, a później eutektyka. W rezultacie mikrostruktura zależy od składu: może dominować eutektyka, mogą dominować kryształy pierwotne, albo oba składniki mogą mieć zbliżone udziały.
Eutektyka z ograniczoną rozpuszczalnością w stanie stałym
W praktyce często spotyka się sytuację pośrednią: w cieczy składniki mieszają się dobrze, natomiast w stanie stałym tworzą roztwory stałe tylko w ograniczonym zakresie. Wtedy zamiast „czystych” faz powstają roztwory stałe graniczne, zwyczajowo oznaczane jako α oraz β, a eutektyka staje się mieszaniną tych dwóch roztworów o składach nasyconych w temperaturze eutektycznej.
To bardzo istotne, bo wraz z dalszym chłodzeniem rozpuszczalność w stanie stałym często maleje, więc roztwory α i β mogą się stawać przesycone. W konsekwencji może dochodzić do wydzieleń wtórnych i dalszego „dojrzewania” struktury już po zakończeniu krzepnięcia. Diagram nie jest więc tylko opisem krystalizacji, ale też przewodnikiem po przemianach w stanie stałym, które wpływają na własności materiału.
Perytektyka
W układach perytektycznych zachodzi przemiana, w której ciecz reaguje z istniejącą fazą stałą, tworząc nową fazę stałą. Dzieje się to w określonej temperaturze, ponieważ w chwili reakcji współistnieją trzy fazy. Mechanizm perytektyczny ma znaczenie praktyczne, bo nowa faza często narasta na kryształach fazy pierwotnej, tworząc warstwę utrudniającą dalszą dyfuzję składników. To może sprawiać, że realny przebieg przemiany odbiega od idealnej równowagi, zwłaszcza przy szybszym chłodzeniu.
Z technologicznego punktu widzenia perytektyka bywa źródłem niejednorodności oraz struktur, które zależą nie tylko od samego wykresu równowagi, ale również od kinetyki, czyli szybkości procesów dyfuzyjnych. Dlatego interpretując diagramy, trzeba pamiętać, że wykres opisuje równowagę, a nie zawsze realny stan „z marszu” bez czasu na wyrównanie składu.
Ograniczona rozpuszczalność w cieczy
Czasem nawet w stanie ciekłym układ nie jest całkowicie jednorodny. Może się zdarzyć, że w pewnym zakresie temperatur ciecz rozdziela się na dwie ciecze o różnych składach, co sprzyja segregacji i powstawaniu obszarów o odmiennych właściwościach. W takim układzie możliwa jest przemiana monotektyczna, w której jedna ciecz przechodzi w drugą ciecz i fazę stałą.
Z punktu widzenia technologii odlewniczej jest to ważne, bo rozdział cieczy może prowadzić do niepożądanej niejednorodności stopu. W praktyce często przeciwdziała się temu przez odpowiednie prowadzenie procesu, między innymi dobór szybkości chłodzenia czy sposobu mieszania ciekłego metalu, aby ograniczyć czas na rozwój segregacji.
Związki chemiczne i fazy międzymetaliczne
W wielu układach powstają związki chemiczne oraz fazy międzymetaliczne. Jeśli związek ma stały skład stechiometryczny, na wykresie pojawia się jako charakterystyczna pozycja odpowiadająca tej proporcji składników. Taki związek może topić się w sposób „podobny do metalu czystego”, gdy przechodzi w ciecz o tym samym składzie, albo może powstawać i zanikać w przemianach typu perytektycznego, gdy proces przebiega poprzez reakcję z cieczą.
Fazy międzymetaliczne często są twarde i kruche, a ich obecność może wyraźnie zmieniać właściwości stopu. Z tego powodu diagramy fazowe są szczególnie ważne w projektowaniu stopów, bo pozwalają przewidzieć, czy w danym zakresie składu i temperatury pojawi się faza, która pogorszy plastyczność, albo odwrotnie – wzmocni stop poprzez drobne wydzielenia.
Przemiany w stanie stałym: eutektoid i perytektoid
Wykresy równowagi nie kończą się na krzepnięciu. W wielu stopach istotne są przemiany zachodzące już po przejściu w stan stały, zwłaszcza gdy rozpuszczalność w roztworach stałych zmienia się wraz z temperaturą lub gdy jeden ze składników wykazuje polimorfizm. Szczególnie ważna jest przemiana eutektoidalna, będąca odpowiednikiem eutektyki, ale zachodząca całkowicie w stanie stałym: jeden roztwór stały rozpada się na dwie fazy stałe w stałej temperaturze. Taka przemiana często prowadzi do drobnej, regularnej struktury i może wyraźnie zmieniać właściwości mechaniczne.
Istnieje również przemiana perytektoidalna, analogiczna do perytektyki, tylko bez udziału cieczy: dwie fazy stałe reagują, tworząc trzecią fazę stałą. W praktyce przemiany w stanie stałym bywają kluczowe, bo to one mogą decydować o twardości, udarności czy odporności na pełzanie, nawet jeśli proces krzepnięcia przebiegł poprawnie.
Znaczenie praktyczne
Najważniejszy wniosek z analizy diagramów jest taki, że własności stopów wynikają przede wszystkim ze struktury, a nie tylko z tego, jakie pierwiastki wchodzą w skład. Stopy jednofazowe są zwykle bardziej jednorodne, a ich własności często zmieniają się bardziej płynnie wraz ze składem. W stopach wielofazowych sytuacja jest bardziej złożona, bo o zachowaniu materiału decydują rodzaj faz, ich udział, rozmieszczenie, wielkość ziaren i morfologia (na przykład postać eutektyki lub charakter wydzieleń).
Dlatego diagram fazowy jest narzędziem, które pomaga łączyć warunki procesu z efektem końcowym. Jeśli wiadomo, w jakich temperaturach i przy jakich składach pojawiają się dane fazy, można świadomie dobierać skład stopu oraz warunki chłodzenia i obróbki cieplnej. W praktyce oznacza to możliwość przewidywania, czy stop będzie miał tendencję do segregacji, czy pojawią się kruche fazy międzymetaliczne, czy da się wykorzystać wydzielenia do umocnienia, albo czy struktura będzie stabilna w warunkach pracy.
Układy równowagi fazowej stopów – podsumowanie
Układy równowagi fazowej to narzędzie, które porządkuje zachowanie stopów w sposób systematyczny i przewidywalny. Dzięki nim można określić, jakie fazy będą stabilne, kiedy zacznie się i skończy krzepnięcie, czy wystąpi eutektyka albo perytektyka, oraz jakie przemiany mogą zajść już w stanie stałym. W praktyce oznacza to możliwość kontrolowania mikrostruktury, a przez to kontrolowania właściwości mechanicznych i fizycznych materiału. Umiejętność czytania diagramów fazowych jest więc jedną z najważniejszych kompetencji w materiałoznawstwie i metalurgii, bo pozwala przełożyć teorię przemian fazowych na realne decyzje inżynierskie.