Biomateriais metálicos

Índice
Os metais desempenham um papel completamente diferente na engenharia biomédica do que as cerâmicas ou os polímeros. Distinguem-se principalmente pelas suas excelentes propriedades mecânicas e alta condutividade elétrica e térmica, e isso deve-se à natureza da ligação metálica – alguns dos eletrões são deslocalizados, formando uma nuvem de «eletrões livres» que são responsáveis pela condutividade e pela ligação forte, embora não direcional, entre os iões metálicos. Esta estrutura permite que os átomos na rede cristalina se movam uns em relação aos outros sem perturbar a ordem, resultando na plasticidade característica dos metais e na capacidade de sofrer grandes deformações sem destruição repentina.
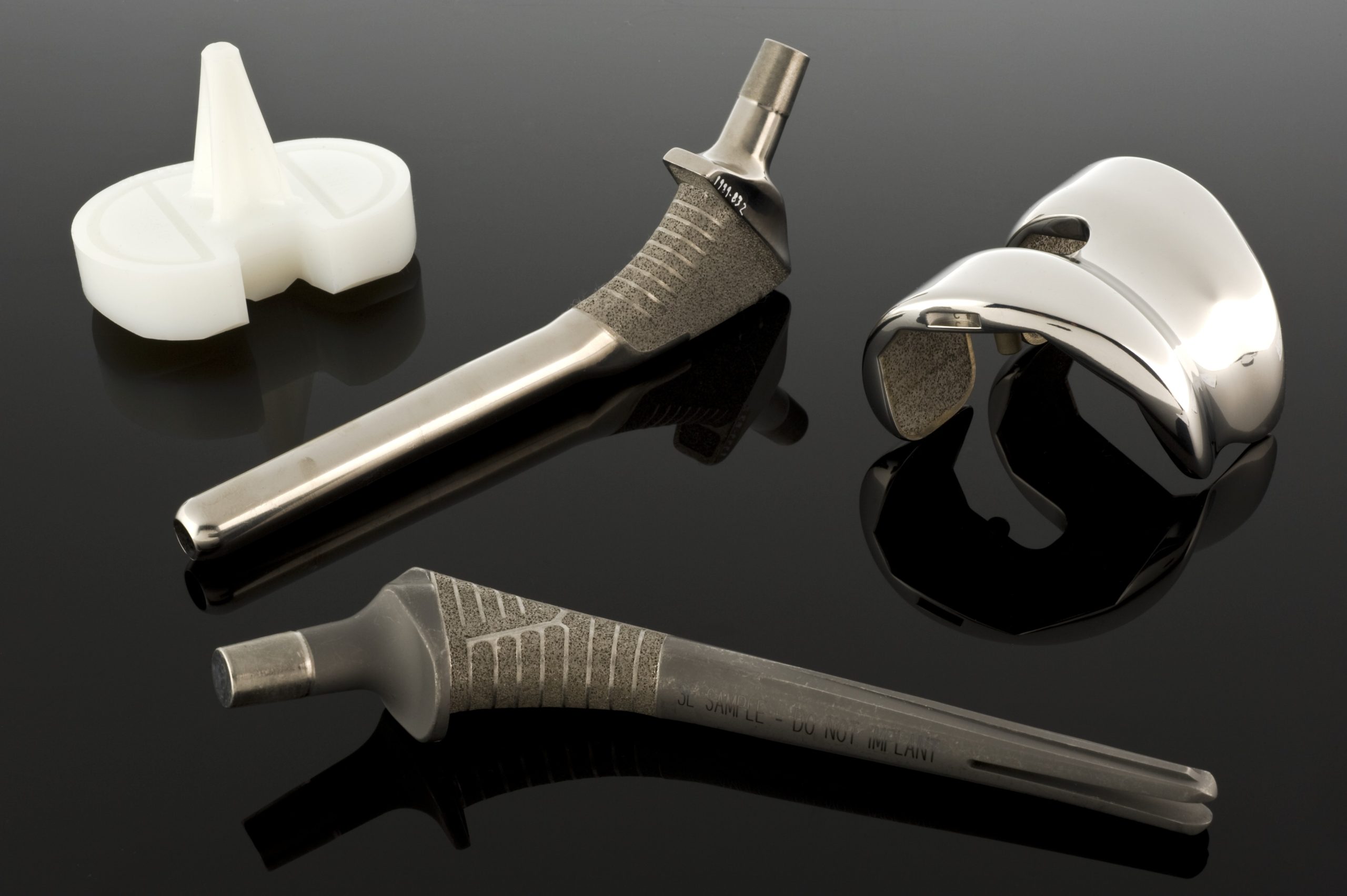
Esta característica é utilizada de forma muito consciente em biomateriais. Os metais servem tanto como substitutos passivos de tecidos duros – em próteses de anca e joelho, placas ósseas, parafusos, pregos intramedulares, implantes dentários – como materiais para dispositivos mais «ativos», tais como stents vasculares, guias de cateteres, fios ortodônticos e implantes cocleares. Nestas aplicações, não é apenas a resistência que conta, mas também a resistência à deformação, a elasticidade, a condutividade e a suscetibilidade ao fabrico de precisão.
A história dos biomateriais metálicos começou com as ligas de aço. A primeira liga desenvolvida especificamente para aplicações ortopédicas foi o aço vanádio, utilizado para fabricar placas e parafusos para fixação de fraturas (conhecidas como placas Sherman). Com o tempo, foi substituído por aços inoxidáveis e, posteriormente, por ligas de cobalto e crómio e ligas de titânio. Estas ligas utilizam vários metais – ferro (Fe), crómio (Cr), cobalto (Co), níquel (Ni), titânio (Ti), tântalo (Ta), nióbio (Nb), molibdénio (Mo) e tungsténio (W) – que, em doses maiores, são tóxicos para o organismo, mas na forma de ligas estáveis e resistentes à corrosão podem ser bem tolerados.
O principal desafio na utilização de metais é a corrosão no ambiente in vivo. Os produtos da corrosão podem levar ao enfraquecimento do próprio implante e a reações biológicas adversas, como inflamação local, descoloração dos tecidos, danos aos órgãos ou respostas imunológicas. Portanto, a engenharia moderna de biomateriais metálicos concentra-se em ligas capazes de formar camadas protetoras duráveis e passivas na superfície e na modificação consciente da superfície para combinar boa resistência, alta resistência à corrosão e uma resposta biológica adequada.
Aços inoxidáveis como materiais para implantes
O aço inoxidável foi um dos primeiros materiais a substituir com sucesso o aço vanádio em implantes. Inicialmente, utilizava-se o aço 18-8 (tipo 302) contendo aproximadamente 18% de crómio e 8% de níquel, com resistência à corrosão significativamente melhor do que os aços carbono clássicos. Com o tempo, surgiu uma variante do 18-8 com a adição de molibdénio (18-8sMo), hoje conhecida como aço 316, seguida por uma modificação com teor reduzido de carbono, o aço 316L. A redução do teor de carbono de aproximadamente 0,08% para um máximo de 0,03% diminui a tendência de formação de carbonetos de crómio nos limites dos grãos, o que melhora a resistência à corrosão em ambientes ricos em cloretos, como os fluidos corporais.
O crómio é o principal responsável pela resistência à corrosão dos aços inoxidáveis. Mesmo com um teor de Cr de 11%, forma-se uma fina camada protetora de óxido na superfície, conferindo ao aço o chamado estado passivo. A adição de molibdénio aumenta a resistência à corrosão por pite em ambientes clorídricos, tornando os aços 316/316L mais adequados para condições fisiológicas. O níquel, por sua vez, estabiliza a fase austenítica (estrutura γ, fcc) à temperatura ambiente, tornando o material não magnético e melhorando a sua resistência à corrosão.
Os aços austeníticos não podem ser endurecidos por tratamento térmico convencional, mas respondem muito bem ao endurecimento por deformação, o que permite ajustar uma ampla gama de propriedades mecânicas – desde estruturas mais dúcteis e macias até estruturas significativamente endurecidas com alta resistência à tração. Os dados mecânicos do aço 316L mostram que, dependendo do grau de deformação a frio, podem ser obtidas diferentes combinações de resistência e ductilidade, o que é importante para adequar o material à função específica do implante.
Apesar das suas inúmeras vantagens, os aços 316 e 316L não são materiais ideais. Em condições de alta tensão, especialmente em áreas com acesso limitado a oxigénio, como em torno de roscas de parafusos ou ligações de placas ósseas, pode ocorrer corrosão em fendas e corrosão por pite, e, a longo prazo, também pode ocorrer corrosão por fadiga. Por este motivo, os aços inoxidáveis costumam ser mais utilizados em implantes temporários, como placas, parafusos, pregos e fios de fixação, que podem ser removidos assim que o osso estiver curado. Para melhorar as suas propriedades, são amplamente utilizadas modificações superficiais – desde polimento e passivação em ácido nítrico até anodização ou implantação de nitrogénio por descarga luminescente, o que aumenta a resistência à corrosão, ao desgaste e à fadiga.
Ligas de cobalto e crómio
Quando os requisitos mecânicos excedem as capacidades dos aços inoxidáveis, entram em cena as ligas de cobalto e crómio. Existem dois grupos principais destas ligas em biomateriais: a liga CoCrMo fundida, usada, entre outras coisas, em copos e cabeças de endopróteses, e a liga CoNiCrMo forjada, usada em componentes de alta carga, como hastes de próteses de anca ou joelho. As normas ASTM descrevem várias versões destes materiais (F75, F90, F562, F563), mas, na prática clínica, CoCrMo e CoNiCrMo são as mais utilizadas.
O cobalto e o crómio formam uma solução sólida até cerca de 65% de Co, e a adição de molibdénio provoca o refinamento dos grãos e, como resultado, um aumento da resistência após a fundição ou forjamento. O crómio desempenha um papel duplo: aumenta a resistência à corrosão através da formação de uma camada de óxido passivo e participa no reforço da solução. Na prática clínica, as ligas de Co-Cr são caracterizadas por um módulo de elasticidade muito elevado – na faixa dos 220 GPa a 234 GPa, superior ao dos aços inoxidáveis, e uma resistência ao desgaste muito boa.
No entanto, esta elevada rigidez tem as suas consequências. Um implante demasiado rígido pode suportar uma carga excessiva, levando ao efeito de blindagem de tensão – uma redução na carga sobre o osso do próprio paciente e a sua reabsorção gradual. Embora o significado clínico deste efeito não seja totalmente claro, constitui um fator importante no design e na forma das hastes protéticas. Por outro lado, a dureza e a resistência à abrasão tornam as ligas de cobalto e crómio uma excelente escolha para pares de atrito «metal-metal», onde é fundamental minimizar o desgaste a longo prazo. Estudos de endopróteses de longo prazo com estes pares indicam uma taxa muito baixa de desgaste linear, da ordem de alguns micrómetros por ano.
Outro aspeto importante é a libertação de iões das ligas de Co-Cr e a sua potencial toxicidade. Experiências com solução de Ringer demonstraram que a taxa de libertação de níquel da liga CoNiCrMo e do aço 316L é muito semelhante após um determinado período, apesar de a liga de cobalto conter um teor de níque cerca de três vezes superior. Estudos in vitro demonstraram que as partículas de cobalto podem ser tóxicas para as células formadoras de osso, enquanto as partículas de crómio e da liga Co-Cr são muito mais bem toleradas. Altas concentrações de extratos de iões Co e Ni perturbam claramente o metabolismo celular em culturas, enquanto os iões de crómio apresentam menor toxicidade.
Titânio e respetivas ligas
Entre os metais utilizados como biomateriais, o titânio ocupa uma posição especial. Na série eletroquímica, é um elemento «ativo», mas num ambiente fisiológico é coberto por uma camada de óxido passiva muito estável, graças à qual a sua corrente de corrosão em soluções fisiológicas é extremamente baixa, da ordem de 10⁻⁸ A/cm². Na prática, os implantes de titânio permanecem visualmente inalterados após um longo período no corpo.
O titânio puro (cp-Ti) e a liga Ti–6Al–4V, a mais popular, combinam uma excelente resistência à corrosão com uma relação resistência/peso favorável. O seu módulo de elasticidade é inferior ao do aço ou das ligas de Co–Cr, o que os aproxima do osso e reduz potencialmente o risco de blindagem de tensão. Por outro lado, o titânio não é tão rígido ou resistente à tensão como os melhores aços ou ligas de cobalto, pelo que o design de elementos de suporte de carga requer uma análise precisa das tensões e, muitas vezes, uma secção transversal maior.
Nas últimas décadas, também foram desenvolvidas ligas de titânio com módulo de elasticidade reduzido e maior resistência à corrosão, contendo, entre outros, Nb e Zr, por exemplo, Ti–13Nb–13Zr, criadas especificamente para próteses articulares. Além disso, foi desenvolvido o endurecimento superficial de ligas de Ti (por exemplo, tratamento termoquímico, nitretação), o que permite combinar a boa biocompatibilidade do substrato com alta resistência ao desgaste em zonas de atrito.
As ligas de níquel-titânio (NiTi), que apresentam memória de forma e superelasticidade, constituem um grupo especial. Graças à transformação martensítica, estes materiais podem reproduzir uma forma previamente registada quando aquecidas acima da temperatura de transformação ou exibir uma deformabilidade elástica muito alta num intervalo de tensão estreito. Esta característica é usada, entre outras coisas, em stents vasculares, arcos ortodônticos e guias de cateteres, permitindo a inserção atraumática de dispositivos e sua expansão estável após a dilatação.
No caso do titânio, as propriedades da superfície são particularmente importantes. Estudos mostram que tanto a rugosidade quanto a química da superfície regulam o comportamento dos osteoblastos e das células formadoras de osso – elas afetam a aderência, a proliferação e a produção de fatores de crescimento e citocinas. O tratamento químico adequado da superfície do Ti e suas ligas pode torná-las bioativas, ou seja, capazes de formar uma camada de apatita em contacto com os fluidos corporais, o que promove a ligação direta com o osso.

Metais na odontologia e outras aplicações especiais
Em odontologia são utilizados tanto os metais preciosos como os metais comuns. O ouro é praticamente resistente à corrosão (resistência do tipo imunidade) e proporciona excelente durabilidade e estabilidade química em reconstruções protéticas. No entanto, as suas limitações são a alta densidade, resistência insuficiente para cargas pesadas e custo, o que significa que praticamente não é utilizado em ortopedia.
A amálgama dentária, uma liga de prata, estanho e mercúrio, também é muito usada. Embora as fases individuais deste material sejam passivas em pH neutro, na prática, a amálgama frequentemente sofre corrosão, especialmente na presença de diferenças de aeração sob a placa bacteriana e microcélulas galvânicas locais. Na verdade, é o material mais propenso à corrosão utilizado na odontologia, o que se manifesta na descoloração e na formação de produtos de corrosão na superfície das obturações.
O grupo de metais especiais também inclui metais de platina e respetivas ligas, usados onde a resistência química e o controlo da condutividade são cruciais, bem como ligas de Ni-Cu e outros sistemas usados em hipertermia – o aquecimento deliberado de tecidos cancerosos usando um campo magnético induzido. Estes tipos de ligas são criados para que a sua resposta térmica num campo eletromagnético seja bem controlada, permitindo o fornecimento preciso de energia térmica ao tumor.
Corrosão de implantes metálicos em ambiente biológico
A corrosão é um fenómeno central para os biomateriais metálicos. No corpo, estamos a lidar com um fluido eletrolítico que contém iões (Na⁺, Cl⁻, HCO₃⁻, fosfatos), pH variável e diferenças de potencial entre diferentes áreas – todos estes fatores favorecem reações eletroquímicas.
Os diagramas de Pourbaix, que mostram a relação entre o potencial eletroquímico e o pH, são usados para descrever a estabilidade dos metais. Eles distinguem entre áreas de corrosão (atividade), passividade e imunidade. No corpo humano, diferentes fluidos têm diferentes níveis de pH e oxigenação: o fluido tecidual geralmente tem um pH em torno de 7,4, mas nas proximidades de uma ferida pode cair para até 3,5, e numa ferida infetada pode subir para 9,0. Isto significa que um metal que apresenta bom desempenho numa área do corpo pode sofrer corrosão noutra.
No entanto, os diagramas de Pourbaix têm limitações – baseiam-se em estados de equilíbrio num sistema simples de metal-água-produtos de reação. A presença de iões cloreto ou moléculas orgânicas complexas pode alterar significativamente o comportamento do metal, e a passividade prevista pode, na prática, revelar-se excessivamente otimista. Portanto, além destes diagramas, são utilizadas curvas de polarização, que permitem determinar a corrente de corrosão e, com base nisso, calcular o número de iões libertados nos tecidos e a taxa de perda de material. Alternativamente, mede-se a perda de massa da amostra durante a exposição numa solução semelhante ao fluido corporal.
A corrosão dos materiais dos implantes pode assumir várias formas. A corrosão uniforme dá origem a uma perda relativamente homogénea do material, mas as formas localizadas são muito mais perigosas. A corrosão por pite causa perdas profundas e localizadas – os aços inoxidáveis são particularmente suscetíveis a isso na presença de cloretos. A corrosão por fendas ocorre em áreas com acesso limitado ao oxigénio, como os espaços entre o parafuso e a placa, onde as condições químicas locais (pH, concentração de iões) diferem significativamente do ambiente circundante. O atrito é uma corrosão associada a micromovimentos de duas superfícies em contacto – a abrasão mecânica destrói a camada passiva, expondo o metal novo e acelerando a corrosão.
A corrosão sob tensão e a corrosão por fadiga são formas especiais de corrosão. Na presença de tensões mecânicas, especialmente repetitivas, a taxa de corrosão pode aumentar e as microfissuras podem propagar-se mais rapidamente. Em implantes de aço inoxidável, por exemplo, foram observadas fraturas de pregos e pinos de anca onde cargas de flexão e um ambiente fisiológico agressivo estavam simultaneamente presentes. Nestes casos, é difícil falar de corrosão «pura». Trata-se sempre de uma interação dinâmica entre química, mecânica e microestrutura.
Diferentes metais comportam-se de maneira diferente nesse aspeto. Metais preciosos, como o ouro, são praticamente resistentes à corrosão. O seu potencial eletroquímico padrão é positivo e, nos diagramas de Pourbaix, ocupam a área de imunidade. O titânio e as ligas de Co-Cr baseiam-se na passividade. Formam uma camada de óxido bem aderente e compacta, graças à qual as suas correntes de corrosão são muito baixas e a superfície permanece estável. Os aços inoxidáveis também beneficiam da passividade do crómio, mas a sua camada passiva é menos estável, tornando-os mais suscetíveis à corrosão por pite e fendas. A amálgama dentária, por outro lado, embora parcialmente passiva do ponto de vista termodinâmico, é, na prática, um material altamente suscetível à corrosão, especialmente na presença de biofilme.
Fabrico e processamento de implantes metálicos
O fabrico de implantes metálicos não consiste apenas na moldagem da geometria, mas também no controlo da microestrutura e da condição da superfície, que determinam a resistência à fadiga, a resistência à corrosão e a resposta biológica.
No caso dos aços inoxidáveis, é fundamental que os aços austeníticos endureçam muito rapidamente sob compressão. Isto significa que, durante o trabalho a frio (laminação, trefilagem, dobragem), a sua resistência aumenta, mas, ao mesmo tempo, a sua plasticidade diminui. Para restaurar o nível necessário de deformabilidade, utiliza-se um recozimento intermédio, pelo qual devem ser evitadas temperaturas e tempos propícios à precipitação de carbonetos de crómio nos limites dos grãos, que enfraquecem a resistência à corrosão. Após a moldagem, os componentes são limpos, desoxidados (quimicamente ou abrasivamente) e passivados, geralmente numa solução de ácido nítrico, de acordo com a norma ASTM F86.
As ligas de Co-Cr comportam-se de forma diferente. São altamente suscetíveis ao reforço durante a deformação, o que, em muitos casos, dificulta o forjamento convencional. Por isso, os componentes com geometrias complexas, como cabeças e copos protéticos, são frequentemente fabricados utilizando fundição de precisão (o chamado método de cera perdida). O processo envolve a preparação de um modelo preciso em cera, cobrindo-o com material refratário, queimando a cera e vertendo liga líquida de Co-CrMo no molde a alta temperatura. A temperatura do molde e o tempo de arrefecimento afetam o tamanho dos grãos e o tamanho e distribuição dos carbonetos – uma microestrutura fina aumenta a resistência, mas pode reduzir a resistência à fratura frágil, enquanto grãos e carbonetos maiores melhoram a ductilidade em detrimento da resistência. O projetista deve, portanto, encontrar um equilíbrio entre resistência e resistência à fratura.
Para as ligas de titânio, os processos de fundição, forjamento e tratamento térmico, assim como o tratamento de superfície, são cruciais. O titânio requer uma atmosfera protetora durante o processamento a alta temperatura, pois reage facilmente com o oxigénio e o azoto, formando camadas superficiais frágeis. Após o processamento mecânico inicial, as superfícies dos implantes de titânio são jateadas com areia, gravadas com ácido, anodizadas ou submetidas a uma combinação desses processos, o que resulta numa rugosidade micrométrica favorável e uma camada de óxido modificada. Estudos indicam que as superfícies preparadas desta maneira promovem um crescimento ósseo mais rápido e a formação de uma ligação mecânica forte e, potencialmente, química.
Os processos de fabrico de ligas com memória de forma constituem uma categoria à parte. No seu caso, o controlo preciso da composição química e do tratamento térmico, que determinam as temperaturas de transformação martensítica e a faixa de superelasticidade, é crucial. Os stents NiTi ou os arcos ortodônticos devem atingir a deformação desejada e retornar à forma dentro de uma faixa de temperatura estritamente definida, incluindo condições fisiológicas.
Resumo – Biomateriais metálicos
Os biomateriais metálicos formam uma família extensa, na qual cada material ocupa o seu próprio nicho funcional, definido com bastante precisão. Os aços inoxidáveis, especialmente o tipo 316L, são materiais relativamente baratos e fáceis de processar, com boas propriedades mecânicas e resistência à corrosão suficiente, razão pela qual são utilizados principalmente em implantes temporários e componentes menos críticos. As ligas de Co-Cr oferecem resistência, dureza e tolerância ao desgaste muito elevadas, tornando-as o material de eleição para copos e cabeças protéticas, assim como para hastes, onde a durabilidade sob cargas pesadas é importante. O titânio e as suas ligas, combinando uma resistência à corrosão muito boa, um módulo de elasticidade favorável e uma elevada biocompatibilidade, tornaram-se o «padrão de excelência» para implantes de longa duração, especialmente em ortopedia e implantologia dentária.
As ligas especiais, como NiTi com memória de forma, também desempenham um papel importante, possibilitando estratégias terapêuticas completamente novas – desde stents autoexpansíveis até arcos ortodônticos superelásticos. O ouro e as amálgamas continuam a ser importantes na odontologia, embora as suas aplicações estejam a ser revistas à luz dos requisitos estéticos e de segurança.
O denominador comum para todos os biomateriais metálicos é a necessidade de controlar a corrosão e a interação com os tecidos. Diagramas de Pourbaix, curvas de polarização, testes de fadiga e estudos de toxicidade iónica formam a base para o projeto de engenharia desses materiais. A engenharia de superfície é igualmente importante, pois determina a qualidade da camada passiva, a resistência ao desgaste, a adesão celular e a natureza da ligação com o osso.
Como resultado, a engenharia moderna de biomateriais não considera os metais de forma isolada, mas trata-os como parte de sistemas complexos: um núcleo metálico pode ser revestido com cerâmicas bioativas, envolto por um composto polimérico ou funcionar com estruturas cerâmicas porosas que apoiam a regeneração. Os metais proporcionam capacidade de suporte de carga e plasticidade, as cerâmicas oferecem bioatividade e resistência à abrasão e os polímeros garantem flexibilidade e a capacidade de formar estruturas macias. Juntos, formam a base da implantologia moderna, onde o objetivo não é mais apenas «substituir peças», mas alcançar a reconstrução funcional e biologicamente integrada dos órgãos.