Biomaterialien in Medizin und Zahnmedizin
Inhaltsverzeichnis
Biomaterialien sind das Rückgrat der modernen rekonstruktiven Medizin und Zahnmedizin. Ihre Anwendungsbereiche reichen von Herzklappen und Gelenkendoprothesen bis hin zu intraossären Implantaten, Sensoren, Elektroden und Medikamentenabgabesystemen. Im Mittelpunkt dieses Artikels steht die Vermittlung eines prägnanten, zugleich umfassenden Überblicks zu Definition, Anforderungen an die Biokompatibilität, Hauptklassen, Wechselwirkungsmechanismen mit dem Körper, Testverfahren sowie Abbauprinzipien. Besondere Hervorhebung erfahren dabei wesentliche Aspekte der Oberflächentechnik und der Präzisionsfertigung, welche für den klinischen Erfolg eines Produkts von entscheidender Bedeutung sind. Der Artikel basiert auf der klassischen Monografie „Biomaterials Science: An Introduction to Materials in Medicine” (Biomaterialwissenschaft: Eine Einführung in Materialien in der Medizin), herausgegeben von B.D. Ratner et al. (Academic Press).
Infolgedessen erfordert die Bestimmung ihrer funktionellen Eigenschaften und ihrer Sicherheit, dass Biomaterialien stets im Kontext ihrer klinischen Anwendung, innerhalb einer definierten biologischen Umgebung und nach Durchlaufen der realen Herstellungs- sowie Sterilisationsprozesse analysiert werden.

Was ist ein Biomaterial und was ist Biokompatibilität?
In der in der Literatur verwendeten Terminologie ist ein Biomaterial ein unbelebtes Material, das dazu bestimmt ist, in einem medizinischen Gerät mit einem biologischen System zu interagieren. Die klinische Akzeptanz dieses Materials setzt seine Biokompatibilität voraus, das heißt die Fähigkeit, in einer definierten Anwendung eine angemessene, gezielt induzierte Wirt-Reaktion zu erzeugen, welche den angestrebten therapeutischen Effekt ermöglicht, ohne ein inakzeptables Risiko zu generieren. Diese Definitionen, die unter anderem in den Werken von D. F. Williams sowie in den Einführungskapiteln von Monographien festgehalten sind, bilden inzwischen den Grundstein für die interdisziplinäre Entwicklung dieses Fachgebiets.
Biokompatibilität ist eine Beziehung zwischen Material, Produkt, Patient und Anwendung; dasselbe Material kann in einem Produkt biokompatibel sein, in einem anderen jedoch problematisch.
Historisch betrachtet umfasste die Klasse der Biomaterialien einerseits Metalle, die in Prothesen zum Einsatz kamen, wie beispielsweise Gold in der Zahnmedizin, andererseits wurden auch Materialien wie Glas oder Holz in externen Prothesen verwendet. Das heutige Verständnis der Disziplin hat sich parallel zur Kristallisierung der wissenschaftlichen Gemeinschaft, zu Symposien und zur Gründung wissenschaftlicher Gesellschaften entwickelt; gleichzeitig hat sich die Struktur der Fachliteratur und der Normen herausgebildet.
Die Systematik der in der Medizin und Zahnmedizin verwendeten Materialien umfasst: Metalle, Polymere, Hydrogele, bioresorbierbare Materialien, Keramiken und Glaskeramiken, natürliche Materialien, Verbundwerkstoffe sowie dünne Schichten, Beschichtungen und Oberflächentransplantate, Textilien und funktionelle Materialien (die aktiv auf Reize reagieren). Dies wird in Teil I der Monographie zusammengefasst, und in detaillierten Kapiteln werden die Merkmale, Eigenschaften und Anwendungen der einzelnen Klassen behandelt.
In der klinischen Praxis kommt das Material selten allein vor, sondern bildet ein Medizinprodukt mit einer bestimmten Geometrie, Rauheit, Reinheit und Verarbeitungsgeschichte; beispielsweise beschreiben Kapitel in Teil II und VII Gefäßimplantate, Elektroden, Sensoren, Zahn- und Orthopädieimplantate sowie Arzneimittelabgabesysteme.
Metalle (z. B. Cr-Ni-Mo-Stähle, Co-Cr-Legierungen, Titanlegierungen) bilden nach wie vor die Grundlage für mechanisch belastete Implantate (Platten, Schrauben, Endoprothesen, Ventilkomponenten). Mechanische Eigenschaften, Ermüdungslebensdauer und Korrosionsbeständigkeit sind von größter Bedeutung, und ihr Niveau hängt stark von der Verarbeitungsgeschichte (vom Schmelzen über die Plastische Bearbeitung bis zur Wärmebehandlung) und der Mikrostruktur ab.
Flexibilität, geringe Dichte und einfache Formbarkeit kennzeichnen Polymere, von Thermoplasten über Elastomere bis hin zu vernetzten Harzen. Darüber hinaus lassen sich ihre Mikrostruktur sowie ihre Funktion gezielt modifizieren, beispielsweise für hämokompatible Beschichtungen, leitfähige Gele oder Membranen. Die Kapitel über Polymere betonen die Bedeutung des Molekulargewichts (Mn, Mw), der Polydispersität und der Taktizität für die mechanischen und Verarbeitungseigenschaften. Aus betrieblicher Sicht sind die Glasübergangstemperatur (Tg), die Kristallschmelztemperatur (Tm) und das Gummiplateau, die in DMA-Tests sichtbar werden, von entscheidender Bedeutung.
Keramik und Glaskeramik, von Oxiden (wie Aluminiumoxid und Zirkonoxid) bis hin zu bioaktiven Gläsern, sind entscheidend für Anwendungen, bei denen hohe Härte, chemische Stabilität und Bioaktivität erforderlich sind, z. B. in der restaurativen Zahnmedizin und bei der Reparatur von Knochendefekten. Diese Materialien können eine starke, chemisch vermittelte Bindung mit Gewebe eingehen (Bioaktivität), was im Kurs „Biokeramik” ausführlich behandelt wird.
Natürliche Materialien (Kollagen, Elastin, Polysaccharide) gewinnen aufgrund ihrer Ähnlichkeit mit der extrazellulären Matrix und ihres Potenzials zur Förderung der Regeneration (z. B. Haut- oder Nervengerüste) in der Gewebezüchtung zunehmend an Bedeutung.
Die Materialwahl wird in erster Linie durch die anatomische Lage sowie die spezifische Belastungssituation bestimmt. Herzklappen erfordern eine hohe Resistenz gegenüber Ermüdung und Blutgerinnung, Hüftendoprothesen verlangen nach hoher Festigkeit sowie geeigneten Reibungspaaren, und Zahnimplantate müssen biointegrierbar sein, wobei sie eine biologische Dichtigkeit des Weichgewebedurchgangs gewährleisten. Kapitel VII dokumentiert diese spezifischen Anforderungen für ausgewählte Produkttypen umfassend.
Volumen- und Oberflächeneigenschaften
Bei Biomaterialien unterscheiden wir zwischen Volumeneigenschaften (Festigkeit, Modul, Schlagfestigkeit, Kriechen, Ermüdung und Leitfähigkeit) und Oberflächeneigenschaften (Oberflächenenergie und -chemie, Ladung, Topographie und Grenzschicht nach Proteinadsorption). Den ersten Kontakt mit Blut und Gewebe bestimmen letztere, nämlich die Kaskade aus Proteinadsorption, Zellaktivierung sowie Gerinnungskaskade. Kapitel der Monografie beleuchten die Proteinadsorption, die Reaktion des Blutes auf das Material sowie die Zusammenhänge zwischen Oberflächeneigenschaften und biologischer Reaktion.
Bei Polymeren bestimmen die Architektur der Makromoleküle (linear, verzweigt oder vernetzt), die Kristallinität, die Taktizität und die Molekulargewichtsverteilung die mechanischen und thermischen Reaktionen. Aus technischer Sicht sind die Parameter, die die Verarbeitung (z. B. Spritzguss, Extrusion oder reaktives Formen) und das Verhalten während des Produktlebenszyklus steuern, von entscheidender Bedeutung. Mn/Mw-, Tg- und Tm-Verteilungen sowie DMA-Spektren dienen als Grundlage für die Konstruktion von Membranstrukturen, Beschichtungen und implantierbaren Elastomeren.
Schon geringfügige Variationen in den Oberflächeneigenschaften, wie Chemie, Nanostruktur oder Sterilisationsgeschichte, sind in der Lage, das Proteinadsorptionsprofil signifikant zu modifizieren, was sich wiederum auf die Thrombogenität sowie den Heilungsverlauf auswirkt. Aus diesem Grund ist die Steuerung der Oberflächenbeschaffenheit ebenso wichtig wie die Auswahl der chemischen Zusammensetzung des Materials.
Wie reagiert der Körper auf Biomaterial?
Nach der Implantation wird eine Kette von Wirtsreaktionen ausgelöst, darunter Hämostase, akute Entzündung, Proliferation und Gewebeumbau in Gegenwart eines Fremdkörpers. Dies führt zu einer Fremdkörperreaktion, die durch die chronische Aktivierung von Makrophagen, die Bildung von Fremdkörperriesenzellen und die Entwicklung einer fibrösen Kapsel gekennzeichnet ist. Den Kontakt mit Blut umfassen separate, komplexe Prozesse, darunter die Thrombozytenaktivierung und die Gerinnungskaskade, sowie das Immunsystem mit der Immunologie und dem Komplementsystem. Die Kapitel 4.1, 4.7 präsentieren einen konzeptionellen Rahmen sowie entsprechende Methoden, um diese Reaktionen systematisch zu bewerten.
Das Reaktionsmuster hängt von der Implantationsstelle, der Größe und der Rauheit sowie von der Materialzusammensetzung und dem Oberflächenzustand ab; selbst dasselbe Material kann in Weichgewebe und Periostgewebe unterschiedliche Makrophagenphänotypen induzieren. Daher muss die Bewertung der Biokompatibilität anwendungsspezifisch (in vitro + in vivo) erfolgen.
Die Prüfung von Biomaterialien umfasst in vitro-Studien (Zellen, Proteine und Hämokompatibilität), in vivo-Studien (Tiermodelle und Implantationsstellen), Blut-Material-Tests und die Entwicklung von Tiermodellen, die auf die klinische Indikation zugeschnitten sind. Die in den Abschnitten 5.1–5.5 zusammengestellten Leitlinien schaffen eine gemeinsame Sprache für akademische und industrielle Labore sowie für die behördliche Bewertung. Ergebnisse aus einer Ebene (z. B. in vitro) können nicht direkt auf klinische Ergebnisse übertragen werden; die Triangulation von Daten (in vitro–in vivo–Explantat-Analyse) ist der Goldstandard in der Produktentwicklung und -überwachung.
Abbau und Alterung in einer biologischen Umgebung
Der Körper ist keine einfache Umgebung für die Materialgestaltung. Er ist reich an Proteinen, Enzymen und Zellen, die reaktive Sauerstoff- und Chlorverbindungen erzeugen können. In dieser Umgebung sind Materialien Hydrolyse, Oxidation, Korrosion, Ermüdung, Spannungsrisse und sogar pathologischer Mineralisierung ausgesetzt. Die Abschnitte 6.1–6.5 bieten einen Querschnittsüberblick über die Abbaumechanismen von Polymeren, Metallen und Keramiken.
Von besonderem Aufschluss ist der Mechanismus der Oxidation des Wirtspolymers. Während akuter Entzündungen sezernieren Neutrophile Superoxidanionen sowie Wasserstoffperoxid, und – unter Mitwirkung der Myeloperoxidase – hypochlorige Säure (HOCl). Bei chronischen Entzündungen dominieren Makrophagen gemeinsam mit Riesenzellen und gewährleisten die fortgesetzte Freisetzung reaktiver Sauerstoffspezies. Darüber hinaus kann die MPO-Adhäsion an der Fremdkörperoberfläche die Katalyse an der Implantationsstelle fördern. Diese Umgebung fördert die Oxidation von Ether- und Urethanbindungen sowie die Entstehung von Rissen und Spannungsrissen in Urethan-Elastomeren, Phänomene, die unter anderem in Polyurethan-Komponenten von Elektroden und Herzschrittmacher-Elektroden beobachtet werden.
neue, reaktive Oberfläche; Wasseraufnahme verändert den lokalen pH-Wert und erleichtert die Diffusion von Reagenzien; Hydrolyseprodukte erhöhen die Hydrophilie und das Eindringen von Abbauprodukten. Die Kontrolle der Zusammensetzung, die Stabilisierung durch Antioxidantien und die Restspannungsbedingungen sind für die langfristige Sicherheit von entscheidender Bedeutung.
Bei korrosiven Metallen umfasst der Abbau Lochfraß und Spaltkorrosion, Spannungsrisskorrosion und tribologischen Verschleiß in Reibungspaaren, was zu losen Partikeln und Gewebereaktionen führen kann. Aufgrund ihrer chemischen Stabilität, jedoch auch ihrer Sprödigkeit und Rissanfälligkeit, erfordert die Konstruktion von Keramiken eine strikte Defektkontrolle.
Beispiele für klinische Anwendungen
Herz-Kreislauf-System. Materialien für Klappen, Transplantate, Stents, extrakorporale Systeme und künstliche Organe müssen ein Gleichgewicht zwischen Hämokompatibilität und mechanischer Haltbarkeit sowie Beständigkeit gegen Protein-/Zellablagerungen herstellen. Zu den nicht-thrombogenen Strategien gehören Oberflächenmodifikationen (wie Heparinisierung und Hydrogele) und die Kontrolle der Oberflächenenergie.
Zahnmedizin – Implantate aus Titan und Zirkonium haben die prothetische Rehabilitation revolutioniert. Der Erfolg hängt von der Biointegration mit dem Knochen (genauer gesagt, von der engen Adhäsion und mechanischen Retention) und der Dichtigkeit des Durchgangs durch die Schleimhaut ab. Materialien für Restaurationen (Edelkeramik, Glaskeramik) profitieren von den Fortschritten in der Biokeramik und der Präzisionsbearbeitung.
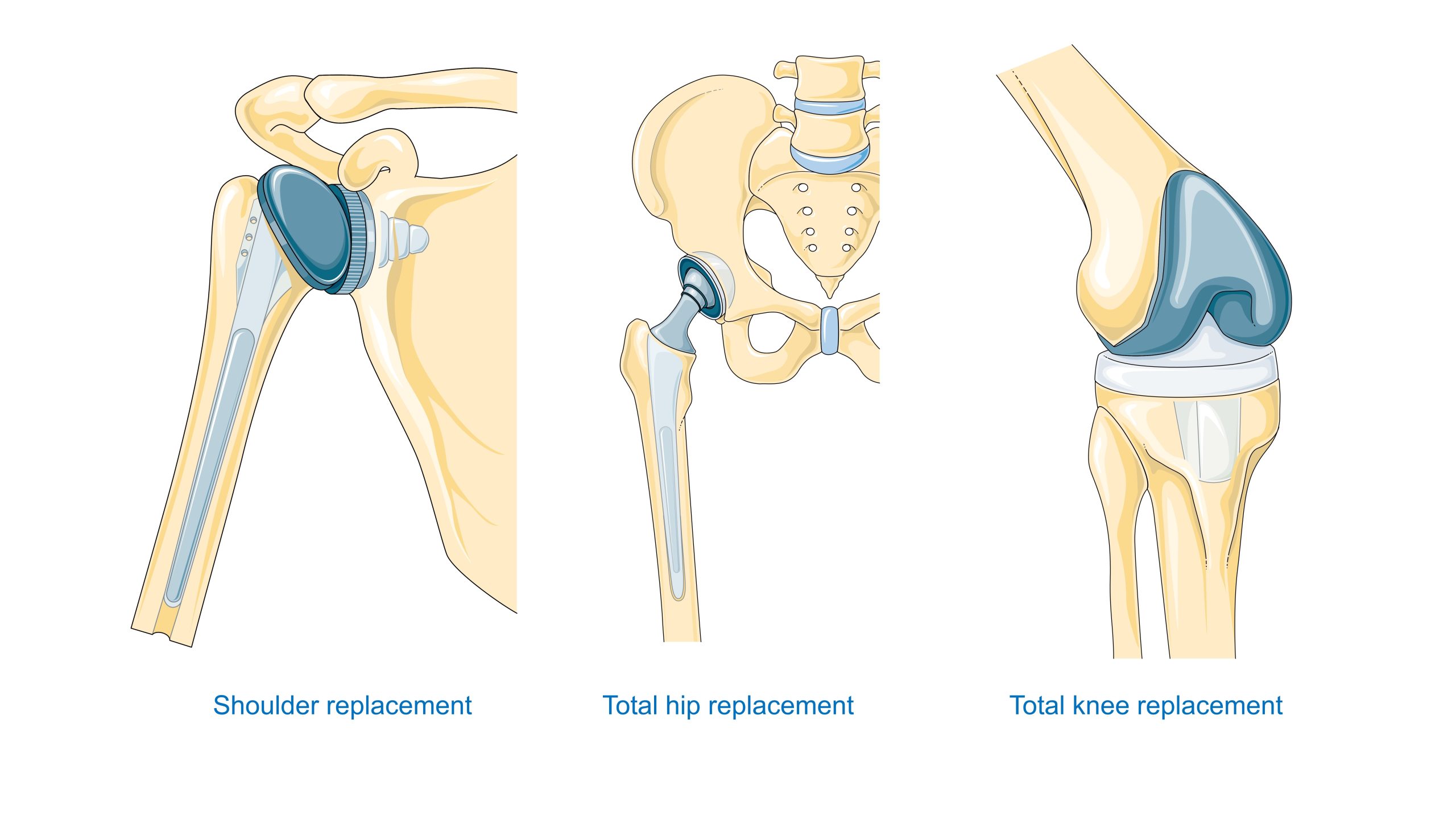
Orthopädie – Für Hüft- und Knieendoprothesen ist ein sorgfältiger Kompromiss zwischen statischer Festigkeit, Dauerfestigkeit, Verschleißfestigkeit sowie den tribologischen Eigenschaften des jeweiligen Reibungspaares, wie Metall, UHMWPE-Polyethylen, Keramik, Keramik oder Metall, Metall, unerlässlich. Die Verbindung mit dem Knochen erweist sich darüber hinaus als kritischer Faktor, wobei ein Vergleich zwischen Acrylzement und porösen Beschichtungen hinsichtlich der Osseointegration durchgeführt wurde.
Präzisionsfertigung, Mikrostruktur und Oberflächentechnik
Bei Metallimplantaten resultieren die Eigenschaften aus der gesamten Verarbeitungskette, vom Schmelzen und Veredeln über plastische Verformung und Wärmebehandlung bis hin zur Bearbeitung, zum Schweißen, Beschichten und Sterilisieren. Die Mikrostruktur (Korngröße, Phasen, Textur) und prozessbedingte Defekte beeinflussen die Ermüdungsfestigkeit und Korrosionsbeständigkeit. Die Einführung von porösen Beschichtungen und Strukturen (z. B. gesinterte Gitter, Plasmaspritzungen) ist ein Beispiel für eine interdisziplinäre Aufgabe: Die Haftung, Steifigkeit, Topografie und Ermüdungsintegrität des gesamten Bauteils müssen ausgewogen sein.
Bei Polymeren sind Verarbeitungsparameter (Temperatur, Zeit und Restspannungen) ebenso wichtig wie die Auswahl von Antioxidationsstabilisatoren und die Reinheitskontrolle, da diese Faktoren die spätere Biostabilität bestimmen. In der klinischen Praxis wurden Spannungsrisse in Polyurethanen beobachtet, die in Herzschrittmacherelektroden zum Einsatz kommen. Diese Defekte manifestieren sich insbesondere an der Schnittstelle zwischen Restspannungen, der biologischen Umgebung sowie der Oxidation durch den Wirt.
Eine Reihe innovativer Werkzeuge zur Eigenschaftsmodifizierung wird durch die Oberflächentechnik bereitgestellt. Hierzu zählen physikalisch-chemische Beschichtungen, die Aufbringung dünner Schichten sowie gepfropfter Polymerschichten, ebenso wie die Mikro- und Nanotopographie. Korrelationen zwischen definierten Oberflächenparametern und resultierenden biologischen Reaktionen werden in speziellen, praxisorientierten Kapiteln detailliert erörtert.
Bei langfristig implantierten Geräten können kleine Prozessentscheidungen (z. B. Art der Sterilisation, Lagerungsbedingungen) Jahre später zu wichtigen Ursachen für klinische Unterschiede werden; die Dokumentation der Verarbeitungshistorie und die Qualitätskontrolle sind integraler Bestandteil des Biomaterialdesigns.
Ethik, Vorschriften und Normen
Produkte werden unter strengen Bewertungssystemen, darunter FDA und ISO, auf den Markt gebracht. Die Kosten für den Nachweis der Sicherheit und Wirksamkeit sind erheblich, aber sie schützen die Patienten und prägen die Qualitätspolitik. Gleichzeitig stellen sich ethische Fragen: Wie lassen sich Patienteninteressen mit wirtschaftlichem Druck in Einklang bringen? Wie lassen sich Studien konzipieren, die mit minimalem Risiko behaftet sind? Wann und wie lassen sich veraltete Lösungen zurückziehen? Im Abschnitt über neue Produkte und Standards werden diese Fragestellungen, einschließlich der Rolle von Konsensstandards sowie der technologischen Entwicklung, ausführlich erörtert. Klinischer Fortschritt erfordert gleichzeitige Fortschritte in den Bereichen Bewertungsmethodik, Standards und Ethik, da Innovation sonst illusorisch oder riskant sein kann.
Ausblick
In Aussicht stehen biologisch funktionale (reaktionsfähige) Materialien und fortschrittliche Biosensor- und künstliche Organsysteme (implantierbar und extrakorporal), die die Biomaterialschnittstelle zum Zentrum der physiologischen Informatik machen. Die subtile Steuerung der Oberflächenwechselwirkungen, die langfristige Stabilität, sowie der Schutz vor Degradation bestimmen den Erfolg maßgeblich. In dem entsprechenden Abschnitt der Monografie wird verdeutlicht, dass Materialien, Elektronik und Biologie bei künstlichen Organen sowie Biosensoren in enger Kooperation agieren müssen. Die Zukunft der Biomaterialien liegt in Hybridsystemen, die eine noch sorgfältigere Kontrolle der Mikrostruktur und Oberfläche erfordern.
Biomaterialien in Medizin und Zahnmedizin – Zusammenfassung
In der Therapie agieren Biomaterialien als aktive Komponenten und prägen die biologische Mikroumgebung maßgeblich. Bestimmende Faktoren sind die Wahl der Materialklasse, die Oberflächengestaltung, die Mikrostruktur, die Verarbeitungsgeschichte sowie das Verständnis der Wirtsreaktion und der Abbaumechanismen im Laufe der Zeit. Metalle, Polymere und Keramiken weisen unterschiedliche Vor- und Nachteile auf, während natürliche Polymere sowie bioaktive Systeme die Palette um regenerative Funktionen erweitern. Aus klinischer Sicht stellt jedes Projekt ein multi-objektives Optimierungsproblem für eine bestimmte Indikation und Patientengruppe dar, das in der Monografie systematisiert wird, angefangen bei Definitionen und Eigenschaften über Kontaktbiologie und Tests bis hin zu den praktischen Aspekten der Implantation und Explantatanalyse. Schließlich sind Präzisionsfertigung und Qualitätskontrolle nicht die letzte Stufe, sondern ein integraler Bestandteil der Biomaterialwissenschaft, da sie das langfristige Verhalten des Materials im Körper bestimmen.
Im Zentrum des Biomaterialdesigns steht die integrative Kompetenz, Materialwissenschaft mit Biologie und Produktentwicklung zu verknüpfen, wobei die Disziplinen Chemie, Mikrostruktur und Oberfläche sowie Herstellung und Sterilisation einbezogen werden. Das Ergebnis ist eine einzige, gut dokumentierte klinische Lösung, die im In-vitro-In-vivo-Klinikpfad verifiziert wurde.
Literaturverzeichnis
Ratner, B.D., Hoffman, A.S., Schoen, F.J., Lemons, J.E. (Hrsg.). Biomaterials Science: An Introduction to Materials in Medicine. Academic Press, San Diego–London–Boston–New York–Sydney–Tokio–Toronto, 1996.