Sistemas de equilíbrio de fase de ligas
Índice
Em metais puros, o curso das transformações é geralmente fácil de compreender: a fusão e a solidificação ocorrem a uma única temperatura definida com precisão, assim como algumas transformações estruturais no estado sólido. As curvas de arrefecimento mostram então pausas características, porque a energia é absorvida ou libertada para a própria transformação, e não para a mudança de temperatura. No caso das ligas, a situação já não é tão «pontual». Muitas vezes, uma liga começa a solidificar a uma temperatura, mas termina a outra, e durante o processo coexistem fases com composições variáveis.
É por isso que os diagramas de equilíbrio de fases, também conhecidos como diagramas de fases, são utilizados na ciência dos materiais. Estes diagramas podem ser tratados como um mapa que mostra as fases que são estáveis dependendo da temperatura e da composição e em que ordem as transformações ocorrem durante o aquecimento e o arrefecimento. Isto permite prever tanto o curso da cristalização e as transformações subsequentes no estado sólido quanto, consequentemente, a estrutura e as propriedades da liga acabada.
Conceitos-chave – sistema, fase e componentes
Para ler os diagramas de equilíbrio corretamente, é necessário compreender a linguagem que eles «falam». Em termos termodinâmicos, um sistema é um fragmento separado da realidade analisado sob determinadas condições, por exemplo, uma amostra de liga que estamos a arrefecer. Uma fase significa uma parte homogénea de um sistema com propriedades idênticas e uma composição química constante, separada de outras fases por um limite de fase. Uma fase pode ser um líquido, uma solução sólida ou uma fase intermetálica específica, caso seja formada.
Os constituintes, ou seja, as substâncias (geralmente elementos) que compõem a liga e a partir das quais as fases podem se formar, também são importantes. No contexto dos diagramas binários, referimo-nos geralmente a um sistema composto por dois constituintes cujas proporções variam na liga. Na prática, isto significa que o diagrama não descreve um único «material», mas sim toda uma família de ligas com composições diferentes, e cada alteração na composição leva-nos a um local diferente no mapa de fases.
Regra da fase de Gibbs
Uma das razões pelas quais o comportamento das ligas difere do comportamento dos metais puros é o número de variáveis que «controlam» o sistema. A regra das fases de Gibbs organiza a relação entre o número de componentes, o número de fases e o número de graus de liberdade. Na prática metalúrgica, costuma assumir-se pressão constante porque o seu efeito nas transições de fase do metal é geralmente pequeno em comparação com o efeito da temperatura e da composição.
O sentido prático é o seguinte: se o sistema tem pouca «margem de manobra», a transição deve ocorrer a uma temperatura (daí as paragens características). No entanto, quando há variabilidade na composição e a possibilidade de coexistência de várias fases, o sistema pode passar por áreas onde duas fases ocorrem simultaneamente, e as suas composições mudam com a temperatura. Então, a solidificação ou as transformações no estado sólido estendem-se por um determinado intervalo de temperatura, e a estrutura é formada em etapas.
Como é criado um diagrama de equilíbrio binário?
Um diagrama binário típico mostra a relação entre temperatura e composição química. O eixo horizontal representa a composição da liga (por exemplo, a percentagem de um componente) e o eixo vertical representa a temperatura. Para construir este diagrama, é realizada uma série de experiências com muitas ligas com diferentes proporções de componentes, e as temperaturas nas quais as transformações ocorrem são registadas – na maioria das vezes por métodos de análise térmica, com base em curvas de arrefecimento e aquecimento.
Os limites das áreas de fase são particularmente importantes no gráfico. Uma linha designada líquido separa a área completamente líquida da área onde o líquido coexiste com a fase sólida. A linha sólida marca o limite abaixo do qual a liga é completamente sólida. Entre o liquidus e o solidus, geralmente há uma área de mistura (por exemplo, fase líquida + fase sólida), o que na prática significa que, durante o arrefecimento, a liga passa por um estágio em que parte do material já está sólida e parte permanece líquida.
Também é importante a forma como a composição das fases a uma determinada temperatura é interpretada. Isso faz-se traçando uma linha horizontal (isotérmica) através do gráfico: a interseção com o liquidus mostra a composição do líquido, e a interseção com o solidus mostra a composição da fase sólida em equilíbrio nessa temperatura. Essa é a base para inferir o que realmente está a acontecer na liga durante o arrefecimento.
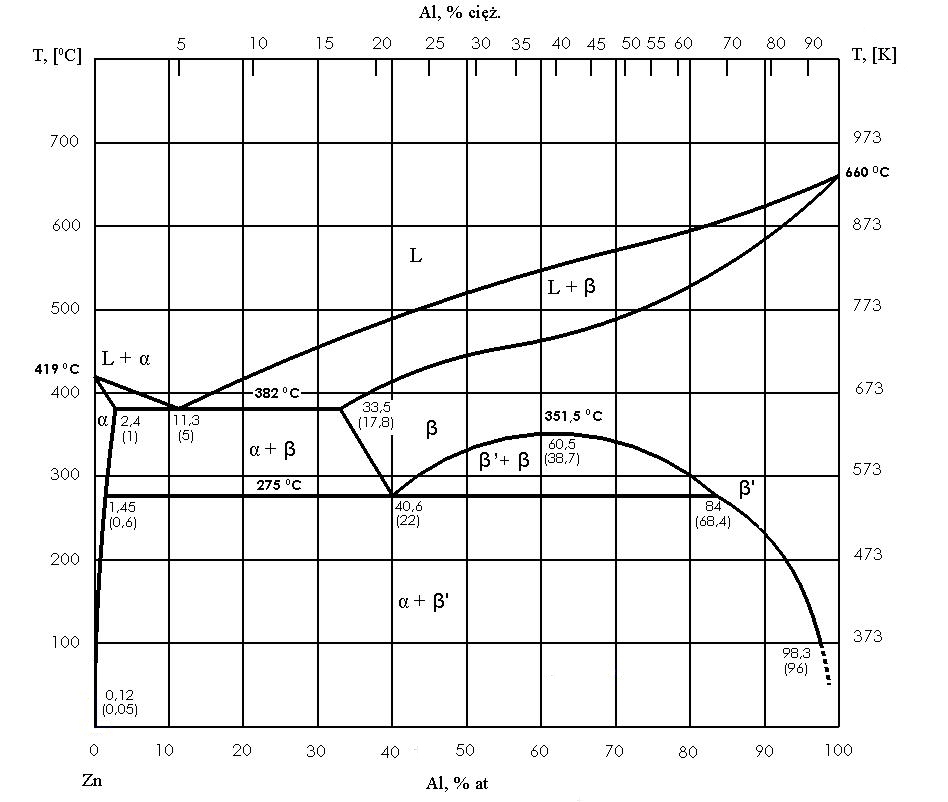
Os tipos mais importantes de sistemas de equilíbrio
Solução sólida contínua
Em alguns sistemas, os componentes misturam-se livremente entre si, tanto no estado líquido como no estado sólido. Neste caso, abaixo de solidus, existe uma fase – uma solução sólida com uma composição que depende da posição no eixo da composição. Durante o arrefecimento, a liga começa a solidificar em liquidus quando os primeiros cristais da solução sólida aparecem e termina em solidus quando a última porção de líquido desaparece. Este é um exemplo clássico de solidificação num intervalo de temperatura, sem uma única paragem.
Vale a pena notar que, na área de «solução líquida + sólida», as composições de ambas as fases são diferentes e mudam com a temperatura. A leitura da isotermia permite determinar qual parte da liga já está em estado sólido num determinado momento e qual parte ainda está líquida.
Eutético
Um sistema eutético é muito característico quando os componentes se misturam num líquido, mas dissolvem-se mal ou não se dissolvem de todo num estado sólido. Neste caso, existe uma composição eutética e uma temperatura na qual um líquido homogéneo se transforma em duas fases sólidas ao mesmo tempo. Essa transformação é isotérmica, portanto, há uma pausa clara na curva de arrefecimento, como no caso do metal puro, mas o mecanismo é diferente: em vez de uma única fase sólida, forma-se uma mistura fina de duas fases, geralmente com uma morfologia específica e regular.
As ligas com uma composição diferente da eutética formam uma estrutura mista. Se a liga for hipereutética, os cristais primários de uma fase são separados primeiro e só depois o resto do líquido solidifica como eutético. Se a liga for hipereutética, os cristais primários da segunda fase aparecem primeiro, seguidos pelos eutéticos. Como resultado, a microestrutura depende da composição: o eutético pode dominar, os cristais primários podem dominar ou ambos os componentes podem ter proporções semelhantes.
Eutético com solubilidade limitada no estado sólido
Na prática, é comum encontrar-se uma situação intermediária: os componentes misturam-se bem no estado líquido, mas no estado sólido formam soluções sólidas apenas em uma extensão limitada. Então, em vez de fases «puras», formam-se soluções de fronteira sólidas, comumente denotadas como α e β, e o eutético torna-se uma mistura dessas duas soluções com composições saturadas na temperatura eutética.
Este aspeto é muito importante porque, com o arrefecimento adicional, a solubilidade no estado sólido geralmente diminui, de modo que as soluções α e β podem tornar-se supersaturadas. Como resultado, podem ocorrer separações secundárias e um maior «amadurecimento» da estrutura após a solidificação estar completa. O diagrama não é, portanto, apenas uma descrição da cristalização, mas também um guia para as mudanças no estado sólido que afetam as propriedades do material.
Peritético
Nos sistemas peritéticos, ocorre uma transformação na qual o líquido reage com a fase sólida existente para formar uma nova fase sólida. Isto acontece a uma temperatura específica, pois três fases coexistem no momento da reação. O mecanismo peritético tem importância prática porque a nova fase frequentemente cresce nos cristais da fase original, formando uma camada que impede a difusão adicional dos componentes. Isto pode fazer com que o curso real da transformação se desvie do equilíbrio ideal, especialmente com um arrefecimento mais rápido.
Do ponto de vista tecnológico, o peritético pode ser uma fonte de heterogeneidade e estruturas que dependem não só do próprio diagrama de equilíbrio, mas também da cinética, ou seja, da velocidade dos processos de difusão. Portanto, ao interpretar diagramas, é importante lembrar que o diagrama descreve o equilíbrio e nem sempre o estado real «em tempo real», sem tempo para que a composição se equalize.
Solubilidade limitada em líquido
Às vezes, mesmo no estado líquido, o sistema não é completamente homogéneo. Pode acontecer que, dentro de um determinado intervalo de temperatura, o líquido se separe em dois líquidos com composições diferentes, o que promove a segregação e a formação de áreas com propriedades diferentes. Neste sistema, é possível ocorrer uma transformação monotética, na qual um líquido se transforma noutro líquido e numa fase sólida.
Do ponto de vista da tecnologia de fundição, este aspeto é importante porque a separação de líquidos pode originar uma heterogeneidade indesejável da liga. Na prática, esta situação é frequentemente neutralizada por um controlo adequado do processo, incluindo a seleção da taxa de arrefecimento ou o método de mistura do metal líquido, no sentido de limitar o tempo para o desenvolvimento da segregação.
Compostos químicos e fases intermetálicas
Em muitos sistemas, formam-se compostos químicos e fases intermetálicas. Se um composto tiver uma composição estequiométrica constante, ele aparece no diagrama como uma posição característica correspondente a essa proporção de componentes. Esse composto pode derreter de maneira «semelhante a um metal puro» quando se transforma num líquido da mesma composição, ou pode formar-se e desaparecer em transformações peritéticas quando o processo prossegue através da reação com o líquido.
As fases intermetálicas são frequentemente duras e frágeis, e a sua presença pode alterar significativamente as propriedades da liga. Por este motivo, os diagramas de fase são particularmente importantes na criação de ligas, pois permitem prever se, dentro de uma determinada faixa de composição e temperatura, surgirá uma fase que prejudicará a plasticidade ou, inversamente, fortalecerá a liga através de precipitados finos.
Transformações do estado sólido: eutetóide e peritetóide
Os diagramas de equilíbrio não terminam com a solidificação. Em muitas ligas, as transformações que ocorrem após a transição para o estado sólido são importantes, especialmente quando a solubilidade em soluções sólidas muda com a temperatura ou quando um dos componentes exibe polimorfismo. De particular importância é a transformação eutetóide, que é equivalente à eutética, mas ocorre inteiramente no estado sólido: uma solução sólida divide-se em duas fases sólidas a uma temperatura constante. Esta transformação geralmente dá origem a uma estrutura fina e regular e pode alterar significativamente as propriedades mecânicas.
Existe também uma transformação peritética, análoga à peritética, mas sem o envolvimento de líquido: duas fases sólidas reagem para formar uma terceira fase sólida. Na prática, as transformações no estado sólido podem ser cruciais, pois podem determinar a dureza, a resistência ao impacto ou a resistência à deformação, mesmo que o processo de solidificação tenha ocorrido corretamente.
Significado prático
A conclusão mais importante da análise dos diagramas é que as propriedades das ligas resultam principalmente da sua estrutura, e não só dos elementos que contêm. As ligas monofásicas são geralmente mais homogéneas e as suas propriedades mudam frequentemente de forma mais suave com a composição. Nas ligas multifásicas, a situação é mais complexa, porque o comportamento do material é determinado pelo tipo de fases, a sua proporção, a distribuição, o tamanho dos grãos e a morfologia (por exemplo, a forma dos eutéticos ou a natureza dos precipitados).
Portanto, um diagrama de fases é uma ferramenta que ajuda a relacionar as condições do processo com o resultado. Se soubermos em que temperaturas e composições determinadas fases ocorrem, podemos selecionar conscientemente a composição da liga e as condições de arrefecimento e tratamento térmico. Na prática, isto significa que é possível prever se a liga tenderá a segregar-se, se irão aparecer fases intermetálicas frágeis, se os precipitados podem ser usados para reforço ou se a estrutura será estável nas condições de operação.
Sistemas de equilíbrio de fase de ligas – resumo
Os sistemas de equilíbrio de fases são uma ferramenta que organiza o comportamento das ligas de forma sistemática e previsível. Podem ser utilizados para determinar quais serão as fases estáveis, quando irá começar e terminar a solidificação, se irão ocorrer fenómenos eutéticos ou peritéticos e que transformações podem ocorrer no estado sólido. Na prática, isto traduz-se na capacidade de controlar a microestrutura e, assim, controlar as propriedades mecânicas e físicas do material. A capacidade de ler diagramas de fase é, portanto, uma das habilidades mais importantes na ciência dos materiais e na metalurgia, pois permite que a teoria das transformações de fase seja traduzida em decisões reais de engenharia.