Eisen-Kohlenstoff-Phasendiagramm
Inhaltsverzeichnis
Eisen und seine Legierungen bilden die Grundlage der modernen Werkstofftechnik. Sie werden zur Herstellung von tragenden Konstruktionen, Werkzeugen, Maschinen und Elementen der industriellen Infrastruktur verwendet. Der Schlüssel zum Verständnis des Verhaltens dieser Werkstoffe sowohl im festen Zustand als auch bei thermischen Prozessen liegt in der Analyse des Eisen-Kohlenstoff-Phasendiagramms (Fe-C).
Die Gleichgewichtsphasenübergänge in Eisenlegierungen mit einem Kohlenstoffgehalt von bis zu etwa 6,7 % werden durch das Fe-C-Phasendiagramm beschrieben. In der Praxis sind jedoch Legierungen mit einem viel geringeren Gehalt dieses Elements von größter Bedeutung, d. h. Stähle (bis zu 2,11 % C) und Gusseisen (über 2,11 % C). Die Kenntnis des Fe-C-Phasendiagramms ermöglicht es uns, Folgendes vorherzusagen:
- Welche Kristallstrukturen sich nach dem Abkühlen in der Legierung bilden
- welche mechanischen und technologischen Eigenschaften sie haben wird
- und wie die Wärmebehandlung geplant werden muss, um den gewünschten Effekt zu erzielen
Aus diesem Grund gilt das Eisen-Kohlenstoff-Phasendiagramm als das wichtigste Phasengleichgewichtsdiagramm in der Metallurgie und bildet die Grundlage für die Konstruktion, Verarbeitung und Modifizierung von Eisenlegierungen.
Eigenschaften des Eisen-Kohlenstoff-Phasendiagramms
Das Eisen-Kohlenstoff-Phasendiagramm (Fe-C) ist ein Diagramm, das die Beziehung zwischen dem Kohlenstoffgehalt und der Temperatur für Eisenlegierungen im thermodynamischen Gleichgewicht darstellt. Dieses Diagramm deckt einen Bereich bis zu 6,67 % C ab, was der chemischen Zusammensetzung von Zementit (Fe₃C) entspricht, einer festen intermetallischen Verbindung aus Eisen und Kohlenstoff.
In der industriellen Praxis sind Legierungen mit einem Kohlenstoffgehalt von bis zu 4,3 %, d. h. Verschiedene Stahl- und Gusseisensorten, sind von größter Bedeutung. Die Phasen und Mikrostrukturen, die bei einer bestimmten Temperatur im Material vorhanden sind, lassen sich anhand dieses Diagramms bestimmen. Außerdem kann man damit ermitteln, welche Phasenumwandlungen beim Abkühlen oder Erhitzen auftreten.
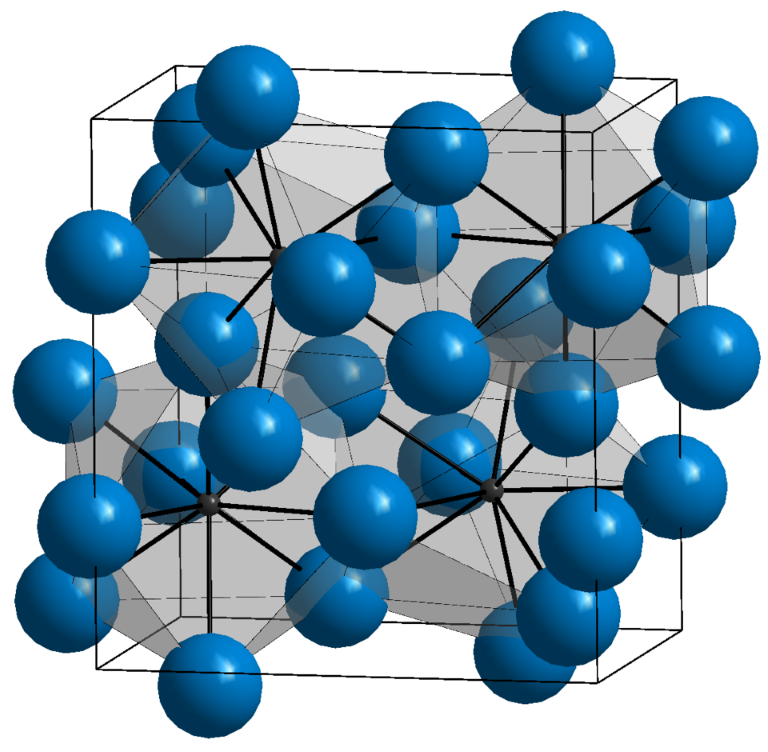
Im Fe-C-Phasendiagramm gibt es drei Hauptphasen: Ferrit (α), eine weiche, duktile Phase mit einem regelmäßigen kubisch-raumzentrierten (BCC) Gitter, die nur Spuren von Kohlenstoff aufnehmen kann; Austenit (γ), eine Phase mit einem regelmäßigen kubisch-flächenzentrierten Gitter (FCC), die bei höheren Temperaturen auftritt und bis zu 2,11 % Kohlenstoff lösen kann; und Zementit (Fe₃C), eine chemische Verbindung mit sehr hoher Härte, aber geringer Plastizität.
Besonders wichtig sind die charakteristischen Punkte des Diagramms: der Eutektoidpunkt (727 °C, 0,8 % C), bei dem Austenit in eine Mischung aus Ferrit und Zementit, d. h. Perlit, umgewandelt wird, und der Eutektikpunkt (1147 °C, 4,3 % C), bei dem das flüssige Metall Ledeburit bildet, eine Mischung aus Austenit und Zementit. Erwähnenswert ist auch die peritektische Umwandlung (1495 °C, 0,16 % C), die jedoch hauptsächlich von theoretischer Bedeutung ist.
Das Fe-C-Phasendiagramm ist ein wichtiges Hilfsmittel, wenn es um die Herstellung von Eisenlegierungen geht. Außerdem hilft es bei der Planung ihrer Wärmebehandlung und der Vorhersage ihrer Eigenschaften.
Zementit, Ferrit und Austenit
Die grundlegenden Phasen, die im Eisen-Kohlenstoff-Phasendiagramm auftreten, sind Zementit (Fe₃C), Ferrit (α) und Austenit (γ). Ihr Vorhandensein, ihre Menge und ihr gegenseitiges Verhältnis bestimmen die Struktur und die Eigenschaften der Legierung sowohl im Rohzustand als auch nach der Wärmebehandlung.
Zementit (Fe₃C) ist eine chemische Verbindung aus Eisen und Kohlenstoff mit einem Kohlenstoffgehalt von 6,67 % C. Es handelt sich um eine sehr harte und spröde Phase mit einer Härte von bis zu 800 HV, die jedoch aufgrund ihrer mangelnden Plastizität allein kein brauchbarer Werkstoff ist. Sie kommt als Bestandteil komplexer Strukturen wie Perlit und Ledeburit vor, wo ihr Vorhandensein die Abriebfestigkeit und Härte des Materials erheblich beeinflusst.
Ferrit (α) ist eine feste Lösung von Kohlenstoff in Alpha-Eisen mit einem raumzentrierten kubisch-raumzentrierten (BCC) Gitter. Es handelt sich um eine weiche, duktile und leicht verarbeitbare Phase, die nur Spuren von Kohlenstoff enthält – maximal 0,02 % bei 727 °C. Dank dieser Eigenschaften ist Ferrit die Hauptphase, die für die Duktilität und Formbarkeit in kohlenstoffarmen Stählen verantwortlich ist.
Austenit (γ) ist eine feste Lösung von Kohlenstoff in Gamma-Eisen mit einem flächenzentrierten kubischen (FCC) Gitter. Diese Phase bildet sich bei höheren Temperaturen und ihre Kohlenstofflöslichkeit erreicht 2,11 % C bei 1147 °C. Austenit ist duktil und nicht magnetisch, was es besonders wertvoll für Wärmebehandlungs- und Oberflächenhärtungsprozesse macht. Darüber hinaus kann Austenit aufgrund seiner Struktur durch schnelles Abkühlen in andere Phasen (z. B. Martensit) umgewandelt werden.
Das Verständnis des Verhaltens von Eisenlegierungen beim Abkühlen, Erhitzen und Sättigen mit Elementen ist grundlegend davon abhängig, wie die Beziehung zwischen den drei Phasen Zementit, Ferrit und Austenit ist. Ingenieure können die Mikrostruktur von Stahl und Gusseisen an spezifische technologische und betriebliche Anforderungen anpassen, und zwar durch kontrollierte Phasenumwandlungen.

Perlit, Ledeburit und Eutektoide
Perlit ist eine feinkörnige, geschichtete Mischung aus zwei Phasen – Ferrit und Zementit –, die durch die eutektoide Umwandlung von Austenit bei einer Temperatur von 727 °C und einem Kohlenstoffgehalt von 0,8 % entsteht. Er hat eine charakteristische lamellare Struktur, die an abwechselnde Schichten erinnert und moderate Härte mit guter Plastizität verbindet. In Kohlenstoffstählen ist Perlit häufig anzutreffen und verantwortlich für die günstige Kombination aus Festigkeit und Bearbeitbarkeit.
Ledeburit ist eine Mischung aus Austenit und Zementit. Er entsteht bei einer Temperatur von 1147 °C und einem Kohlenstoffgehalt von 4,3 % C. Die Mischung ist das Ergebnis einer eutektischen Flüssigkeitsumwandlung. In Gusseisen ist es besonders ausgeprägt und trägt maßgeblich zur hohen Härte und Abriebfestigkeit bei. Allerdings beeinträchtigt es auch die Duktilität und Bearbeitbarkeit des Materials. Bei weiterer Abkühlung unterliegt das in Ledeburit enthaltene Austenit sekundären Umwandlungen, z. B. in Perlit oder Bainit, je nach Abkühlgeschwindigkeit.
Eutektoide und Eutektika sind besondere Punkte im Fe-C-Gleichgewichtsdiagramm, an denen eine Phase in ein Gemisch aus zwei anderen übergeht:
- Im Fall des Eutektoids zerfällt Austenit in Ferrit und Zementit (Perlit);
- im Fall des Eutektikums erstarrt das flüssige Metall direkt zu einem Gemisch aus Austenit und Zementit (Ledeburit).
Klassifizierung von Eisen-Kohlenstoff-Legierungen: Stähle und Gusseisen
Die Einteilung von Eisen-Kohlenstoff-Legierungen erfolgt nicht nur anhand ihrer Struktur, sondern in erster Linie anhand ihres Kohlenstoffgehalts. Der Grenzwert, ab dem die beiden Hauptwerkstoffgruppen getrennt werden, liegt bei 2,11 % C. Dies entspricht dem Eutektoidpunkt im Fe-C-Phasendiagramm.
Stähle sind Eisenlegierungen, die bis zu 2,11 % Kohlenstoff enthalten. Sie zeichnen sich durch gute Plastizität, Duktilität und Bearbeitbarkeit aus. Dank des Vorhandenseins von Austenit, Ferrit und Perlit können Stähle gehärtet, geglüht und vergütet werden, wodurch ihre Struktur verändert und ihre Eigenschaften an spezifische Anwendungen angepasst werden können. Unter anderem werden folgende Arten unterschieden:
- kohlenstoffarme Stähle (bis zu 0,3 % C) – weich, leicht schweißbar, werden in tragenden Konstruktionen verwendet
- kohlenstoffmittlere Stähle (0,3–0,6 % C) – mit ausgewogenen Festigkeitseigenschaften
- kohlenstoffreiche Stähle (über 0,6 % C) – hart, verschleißfest, werden für Werkzeuge verwendet
Gusseisen sind Legierungen mit einem Kohlenstoffgehalt von über 2,11 % C, wodurch sie durch eutektische Umwandlungen erstarren und Ledeburit enthalten. Diese Werkstoffe sind verschleißfest, leicht gießbar und relativ kostengünstig, jedoch auch spröde und schwer zu bearbeiten. Je nach Form, in der Kohlenstoff in der Struktur vorliegt (Zementit oder Graphit), werden folgende Arten unterschieden:
- Weißes Gusseisen – mit Zementit, sehr hart, aber spröde
- Grauguss – mit Flockengraphit, besser bearbeitbar und vibrationsdämpfend
- Sphäroguss (SG) – mit Kugelgraphit, mit besseren Festigkeitseigenschaften
- Duktiles Eisen – wärmebehandelt, mit feinem Graphit, was zu einer erhöhten Duktilität führt
Anwendung des Fe-C-Gleichgewichtsdiagramms in der industriellen Praxis
Das Eisen-Kohlenstoff-Phasendiagramm (Fe-C-Diagramm) ist eines der wichtigsten Werkzeuge in der Werkstofftechnik. Die strukturellen Veränderungen, die in Eisenlegierungen beim Erhitzen und Abkühlen auftreten, können verstanden und vorhergesagt werden, was für die Planung technologischer Prozesse und die Analyse der Leistungsfähigkeit von Werkstoffen von entscheidender Bedeutung ist.
Mithilfe des Diagramms können unter anderem Phasenübergänge bei bestimmten Temperaturen bestimmt, die in einem bestimmten Temperaturbereich vorhandenen Kristallstrukturen identifiziert und die Veränderungen der mechanischen Eigenschaften einer Legierung mit ihrem Kohlenstoffgehalt verstanden werden. In der Praxis ermöglicht dies Ingenieuren, den gesamten Materialverarbeitungsprozess vom Gießen bis zur abschließenden Wärmebehandlung zu planen. Die Kenntnis des Diagramms wird verwendet bei:
- der Auswahl von Wärmebehandlungsparametern wie Härten, Glühen, Anlassen oder Normalisieren
- der Strukturdiagnostik von Werkstoffen, insbesondere bei der Beurteilung der Gussqualität oder der Erkennung von thermischen Fehlern
- der Auslegung von Legierungszusammensetzungen für spezifische mechanische, thermische und korrosionsbezogene Anwendungen
Erwähnenswert ist auch, dass das Fe-C-Diagramm als Ausgangspunkt für das Verständnis komplexerer Phasendiagramme dient, beispielsweise bei legierten Stählen, in denen neben Kohlenstoff weitere Elemente wie Chrom, Nickel oder Molybdän vorhanden sind, die Phasenumwandlungen und die Bildung neuer Strukturen beeinflussen.
Deshalb wird es in fast allen Bereichen der Herstellung und Verwendung von Eisenlegierungen eingesetzt. Das reicht von der Entwicklung der chemischen Zusammensetzung über Simulationen thermischer Umwandlungen bis hin zur Optimierung der Haltbarkeit und Zuverlässigkeit fertiger Maschinenteile und Strukturen.
Eisen-Kohlenstoff-Phasendiagramm – Zusammenfassung
Das Eisen-Kohlenstoff-Phasendiagramm (Fe-C-Diagramm) ist sehr wichtig für die moderne Werkstofftechnik und Metallurgie. Die Auswirkungen von Änderungen des Kohlenstoffgehalts und der Temperatur auf die Mikrostruktur, die mechanischen Eigenschaften und das technologische Verhalten von Eisenlegierungen können wir verstehen. Ingenieure können technologische Prozesse bewusst gestalten und die geeigneten Werkstoffe für verschiedene Anwendungen auswählen, wenn sie über dieses Wissen verfügen.
Das Verständnis des Fe-C-Diagramms ermöglicht die Kontrolle über Phasenumwandlungen, wie beispielsweise die eutektoide Umwandlung von Austenit zu Perlit oder die eutektische Erstarrung von Gusseisengruppenlegierungen zu einer Ledeburitstruktur. Dadurch lassen sich Härte, Plastizität, Abriebfestigkeit und Wärmebehandlungsfähigkeit präzise steuern, was sich direkt in der Haltbarkeit und Zuverlässigkeit von Bauteilen niederschlägt.
Das Fe-C-Phasendiagramm mag auf den ersten Blick einfach erscheinen, aber seine praktische Bedeutung ist enorm. Die Analyse hat ergeben, dass Stahl und Gusseisen konstruiert, modifiziert und auf ihre Mikrostruktur und die Ursachen von Schäden in Fertigprodukten diagnostiziert werden müssen. In diesem Sinne ist das Fe-C-Gleichgewichtsdiagramm nicht nur ein akademisches Werkzeug, sondern ein alltägliches Instrument für Ingenieure, das ihnen ermöglicht, Theorie und Praxis zum Nutzen der Haltbarkeit, Sicherheit und Effizienz aller technischen Infrastrukturen auf Eisenbasis zu verbinden.