Metalliset biomateriaalit

Sisällysluettelo
Metallit ovat biolääketieteellisessä tekniikassa täysin erilaisessa roolissa kuin keraamit tai polymeerit. Ne erottuvat ensisijaisesti erinomaisista mekaanisista ominaisuuksistaan sekä korkeasta sähkön- ja lämmönjohtavuudestaan. Tämä johtuu metallisen sidoksen luonteesta – osa elektroneista on delokalisoituneita, muodostaen ”vapaiden elektronien” pilven, joka vastaa johtavuudesta ja metallionien välisestä vahvasta, vaikkakin ei-suuntautuneesta sidoksesta. Tämä rakenne mahdollistaa atomien liikkumisen kidehilan sisällä suhteessa toisiinsa häiritsemättä järjestystä, mikä johtaa metallien plastisuuteen ja kykyyn kestää suuria muodonmuutoksia ilman äkillistä tuhoutumista.
Tätä ominaisuutta hyödynnetään hyvin tietoisesti biomateriaaleissa. Metallit toimivat sekä passiivina korvikkeina kovalle kudokselle – lonkka- ja polviproteeseissa, luulevyissä, ruuveissa, intramedullaarisissa nauloissa, hammasimplantteissa – että materiaaleina aktiivisemmille laitteille, kuten verisuonistentteille, katetrinohjaimille, oikomishoidon langoille ja sisäkorvaistutteille. Näissä sovelluksissa merkitystä ei ole vain lujuudella, vaan myös muovattavuudella, joustavuudella, johtavuudella ja herkkyydellä tarkalle valmistukselle.
Metallisten biomateriaalien historia alkoi terässeoksista. Ensimmäinen ortopedisiin sovelluksiin kehitetty seos oli vanadiiniteräs, jota käytettiin murtumien kiinnittämiseen tarkoitettujen levyjen ja ruuvien valmistukseen (tunnetaan nimellä Sherman-levyt). Ajan myötä se korvattiin ruostumattomilla teräksillä ja myöhemmin koboltti- ja kromiseoksilla sekä titaaniseoksilla. Näissä seoksissa käytetään useita metalleja – rautaa (Fe), kromia (Cr), kobolttia (Co), nikkeliä (Ni), titaania (Ti), tantaalia (Ta), niobiumia (Nb), molybdeeniä (Mo) ja volframia (W) – jotka suurina annoksina ovat myrkyllisiä keholle, mutta vakaiden, korroosionkestävien seosten muodossa hyvin siedettyjä.
Metallien käytön suurin haaste on korroosio in vivo -ympäristössä. Korroosiotuotteet voivat heikentää implanttia ja aiheuttaa haitallisia biologisia reaktioita, kuten paikallista tulehdusta, kudosten värimuutoksia, elinvaurioita tai immuunivasteita. Siksi nykyaikaisessa metallisten biomateriaalien suunnittelussa keskitytään seoksiin, jotka muodostavat kestävän, passiivisen suojakerroksen pinnalle, sekä tietoiseen pinnan muokkaukseen, jotta saavutetaan hyvä lujuus, korkea korroosionkestävyys ja sopiva biologinen vaste.
Ruostumattomat teräkset implanttimateriaaleina
Ruostumaton teräs oli yksi ensimmäisistä materiaaleista, joka korvasi menestyksekkäästi vanadiiniteräksen implantteissa. Alun perin käytettiin 18-8-terästä (tyyppi 302), joka sisälsi noin 18 % kromia ja 8 % nikkeliä ja jonka korroosionkestävyys oli huomattavasti parempi kuin perinteisten hiiliterästen. Ajan myötä markkinoille tuli 18-8-teräksen muunnos, johon oli lisätty molybdeeniä (18-8sMo) ja joka tunnetaan nykyään nimellä 316-teräs. Sen jälkeen kehitettiin muunnos, jonka hiilipitoisuus oli pienempi – 316L-teräs. Hiilipitoisuuden vähentäminen noin 0,08 %:sta enintään 0,03 %:iin vähentää kromikarbidien muodostumista raerajoilla, mikä parantaa korroosionkestävyyttä kloridipitoisissa ympäristöissä, kuten kehon nesteissä.
Kromi on ensisijaisesti vastuussa ruostumattomien terästen korroosionkestävyydestä. Jo 11 %:n kromipitoisuudella teräksen pinnalle muodostuu ohut suojaava oksidikerros, joka antaa teräkselle ns. passiivisen tilan. Molybdeenin lisääminen lisää vastustuskykyä pistekorroosiota vastaan kloridiympäristöissä, mikä tekee 316/316L-teräksistä sopivampia fysiologisille olosuhteille. Nikkelin puolestaan stabiloi austeniittisen faasin (γ, fcc-rakenne) huoneenlämmössä, mikä tekee materiaalista ei-magneettisen ja parantaa sen korroosionkestävyyttä.
Austeniittiset teräkset eivät kovetu tavanomaisella lämpökäsittelyllä, mutta ne reagoivat erittäin hyvin työstökarkaisuun. Tämä mahdollistaa monenlaisten mekaanisten ominaisuuksien säätämisen – joustavammista, pehmeistä rakenteista huomattavasti kovettuneisiin rakenteisiin, joilla on suuri vetolujuus. 316L-teräksen mekaaniset tiedot osoittavat, että kylmämuovauksen asteesta riippuen voidaan saavuttaa erilaisia lujuuden ja sitkeyden yhdistelmiä, mikä on tärkeää materiaalin sovittamiseksi implantin erityiseen toimintaan.
Monista eduistaan huolimatta 316- ja 316L-teräkset eivät ole ihanteellisia materiaaleja. Suurten rasitusten alaisina, etenkin alueilla, joilla hapen saatavuus on rajoitettua, kuten ruuvikierteiden tai luulevyjen liitoskohdissa, voi esiintyä rako- ja pistekorroosiota, ja pitkällä aikavälillä myös väsymiskorroosiota. Tästä syystä ruostumattomia teräksiä käytetään yleisimmin väliaikaisissa implantteissa, kuten levyissä, ruuveissa, nauloissa ja kiinnityslangoissa, jotka voidaan poistaa luun parannuttua. Niiden ominaisuuksien parantamiseksi käytetään laajalti pintakäsittelyjä – kiillotuksesta ja passivoinnista typpihapossa anodisointiin tai typpien implantointiin hehkutulpan avulla, mikä lisää korroosion-, kulumisen- ja väsymiskestävyyttä.
Koboltti- ja kromiseokset
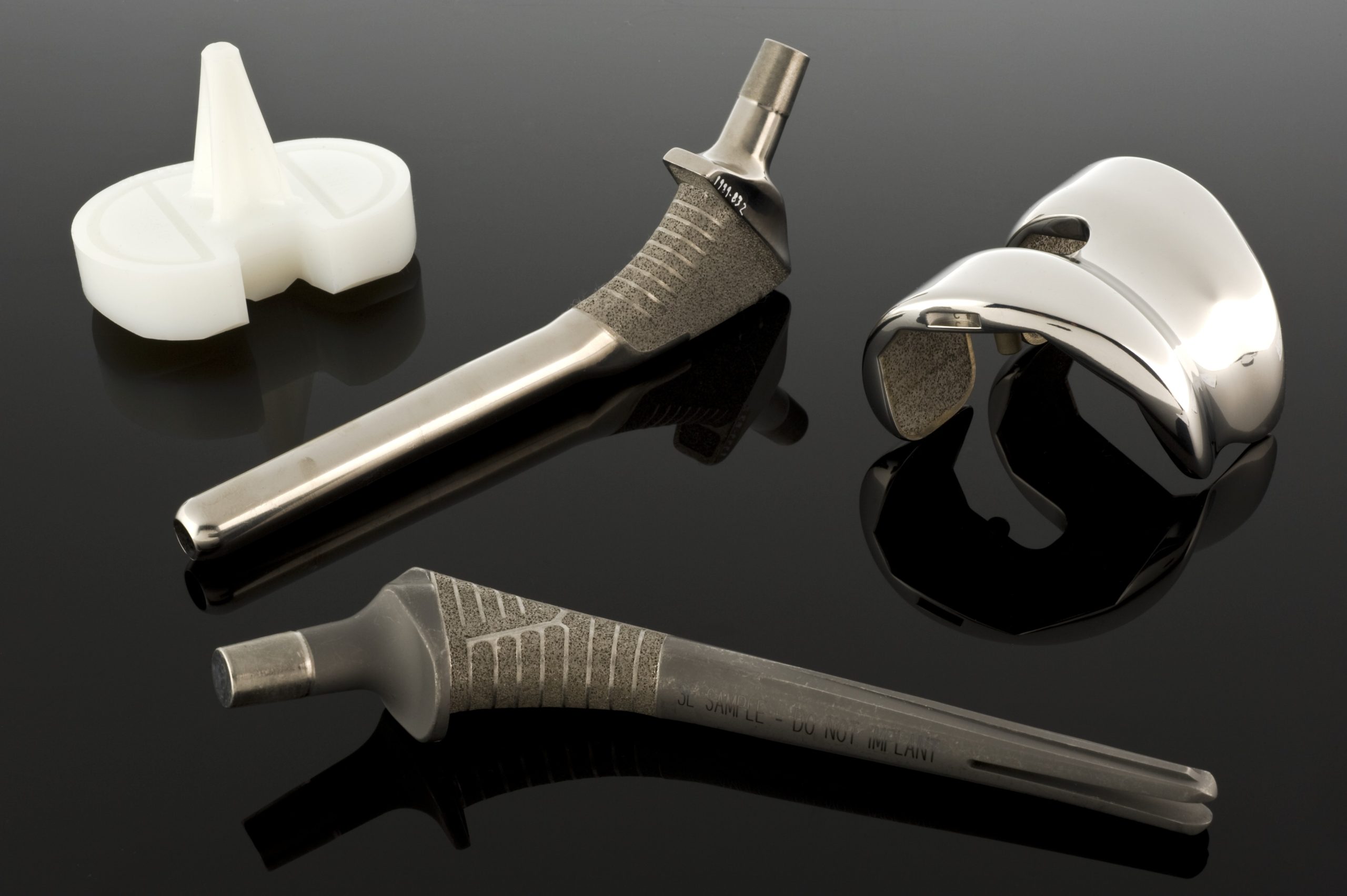
Kun mekaaniset vaatimukset ylittävät ruostumattomien terästen kyvyt, koboltti- ja kromiseokset tulevat kyseeseen. Biomateriaaleissa on kaksi pääryhmää tällaisia seoksia: valettu CoCrMo-seos, jota käytetään muun muassa endoproteesien kuppeihin ja päihin, ja taottu CoNiCrMo-seos, jota käytetään suurten kuormitusten komponentteihin, kuten lonkka- tai polviproteesien varsiin. ASTM-standardit kuvaavat useita versioita tällaisista materiaaleista (F75, F90, F562, F563), mutta kliinisessä käytännössä CoCrMo ja CoNiCrMo ovat hallitsevassa asemassa.
Koboltti ja kromi muodostavat kiinteän liuoksen, jonka kobolttipitoisuus on enintään noin 65 %, ja molybdeenin lisääminen aiheuttaa rakeiden hienontumisen ja sen seurauksena lujuuden kasvun valun tai taonnan jälkeen. Kromilla on kaksi tehtävää: se lisää korroosionkestävyyttä muodostamalla passiivisen oksidikerroksen ja osallistuu liuoksen lujittamiseen. Kliinisessä käytännössä Co–Cr-seokset ovat erittäin joustavia – niiden kimmokerroin on 220–234 GPa, mikä on enemmän kuin ruostumattomilla teräksillä, ja niiden kulutuskestävyys on erittäin hyvä.
Tällä suurella jäykkyydellä on kuitenkin seurauksia. Liian jäykkä implantti voi ottaa liian suuren osan kuormituksesta, mikä johtaa stressisuojaukseen – potilaan oman luun kuormituksen vähenemiseen ja sen asteittaiseen resorptioon. Vaikka tämän vaikutuksen kliininen merkitys ei ole täysin selvä, se on tärkeä tekijä proteesivarren suunnittelussa ja muodossa. Toisaalta kovuus ja kulutuskestävyys tekevät koboltti- ja kromiseoksista erinomaisen valinnan ”metalli-metalli”-kitkapareille, joissa pitkäaikaisen kulumisen minimointi on ratkaisevan tärkeää. Tällaisia pareja käyttävien pitkäaikaisten endoproteesien tutkimukset osoittavat, että lineaarinen kuluminen on hyvin vähäistä, muutamia mikrometrejä vuodessa.
Toinen tärkeä kysymys on Co-Cr-seosten ionien vapautuminen ja niiden mahdollinen myrkyllisyys. Ringerin liuoksessa tehdyt kokeet ovat osoittaneet, että nikkelin vapautumisnopeus CoNiCrMo-seoksesta ja 316L-teräksestä on hyvin samanlainen tietyn ajan kuluttua, vaikka kobolttiseos sisältää noin kolme kertaa enemmän nikkeliä. In vitro -tutkimukset ovat osoittaneet, että kobolttipartikkelit voivat olla myrkyllisiä luunrakentaville soluille, kun taas kromi- ja Co-Cr-seospartikkelit ovat paljon paremmin siedettyjä. Korkeat Co- ja Ni-ioniuutteen pitoisuudet häiritsevät selvästi solujen aineenvaihduntaa viljelmissä, kun taas kromi-ionit ovat vähemmän myrkyllisiä.
Titaani ja sen seokset
Biomateriaaleina käytettävistä metalleista titaani on erityisessä asemassa. Sähkökemiallisessa sarjassa se on ”aktiivinen” alkuaine, mutta fysiologisessa ympäristössä se on peitetty erittäin vakaalla, passiivisella oksidikerroksella, jonka ansiosta sen korroosiovirta fysiologisissa liuoksissa on erittäin alhainen, suuruusluokkaa 10⁻⁸ A/cm². Käytännössä titaanista valmistetut implantit pysyvät ulkonäöltään muuttumattomina pitkän ajan kuluttua kehossa.
Puhdas titaani (cp-Ti) ja suosituin Ti–6Al–4V-seos yhdistävät erittäin hyvän korroosionkestävyyden ja suotuisan lujuus-painosuhteen. Niiden kimmokerroin on alhaisempi kuin teräksen tai Co–Cr-seosten, mikä lähentää niitä luuhun ja vähentää mahdollisesti stressisuojauksen riskiä. Toisaalta titaani ei ole yhtä jäykkä tai vetolujuudeltaan yhtä vahva kuin parhaat teräkset tai kobolttiseokset, joten kuormitusta kantavien elementtien suunnittelu vaatii tarkkaa jännitysanalyysiä ja usein suuremman poikkileikkauksen.
Viime vuosikymmeninä on kehitetty myös titaaniseoksia, joiden kimmokerroin on pienempi ja korroosionkestävyys parempi ja jotka sisältävät muun muassa Nb:tä ja Zr:ää, esim. Ti–13Nb–13Zr, jotka on suunniteltu erityisesti nivelproteeseja varten. Lisäksi on kehitetty Ti-seosten pintakovettaminen (esim. termokemiallinen käsittely, nitraus), joka mahdollistaa substraatin hyvän biologisen yhteensopivuuden yhdistämisen korkeaan kulutuskestävyyteen kitkavyöhykkeillä.
Nikkelititaaniseokset (NiTi), joilla on muotomuistia ja superelastisuutta, muodostavat erityisen ryhmän. Martensiittisen muutoksen ansiosta ne voivat palautua aiemmin tallennettuun muotoon, kun ne lämmitetään muutostemperaturin yläpuolelle, tai ne voivat osoittaa erittäin suurta elastista muovautuvuutta kapealla jännitysalueella. Tätä ominaisuutta käytetään muun muassa verisuonistentteissä, oikomishoidon kaarissa ja katetrinohjaimissa, mikä mahdollistaa laitteiden atraumattisen asettamisen ja niiden vakaan laajenemisen laajennuksen jälkeen.
Titaanin tapauksessa pinnan ominaisuudet ovat erityisen tärkeitä. Tutkimukset osoittavat, että sekä karheus että pinnan kemiallinen koostumus säätelevät osteoblastien ja luunmuodostus solujen käyttäytymistä – ne vaikuttavat adheesioon, proliferaatioon sekä kasvutekijöiden ja sytokiinien tuotantoon. Ti:n ja sen seosten pinnan asianmukainen kemiallinen käsittely voi tehdä niistä bioaktiivisia, eli kykeneviä muodostamaan apatiittikerroksen kosketuksessa kehon nesteiden kanssa, mikä edistää suoraa sitoutumista luuhun.

Metallit hammaslääketieteessä ja muissa erikoissovelluksissa
Hammaslääketieteessä käytetään sekä jalometalleja että perusmetalleja. Kulta on käytännössä korroosionkestävää (immuniteettityyppinen kestävyys) ja tarjoaa erinomaisen kestävyyden ja kemiallisen vakauden proteettisissa rekonstruktioissa. Sen rajoituksia ovat kuitenkin suuri tiheys, riittämätön lujuus raskaille kuormille ja hinta, mikä tarkoittaa, että sitä ei käytännössä käytetä ortopediassa.
Hammasamalgaami, hopean, tinan ja elohopean seos, on yleisesti käytetty materiaali. Vaikka tämän materiaalin yksittäiset faasit ovat passiivisia neutraalissa pH-arvossa, käytännössä amalgaami usein syöpyy, erityisesti bakteeripinnoitteen alla esiintyvien ilmastuserotusten ja paikallisten galvaanisten mikrosolujen vaikutuksesta. Se on itse asiassa hammaslääketieteessä käytetyistä materiaaleista kaikkein syöpymisalttiin, mikä ilmenee värimuutoksina ja syöpymistuotteiden muodostumisena täytteiden pinnalle.
Erikoismetallien ryhmään kuuluvat myös platinametallit ja niiden seokset, joita käytetään tilanteissa, joissa kemiallinen kestävyys ja johtavuuden hallinta ovat ratkaisevia, sekä Ni-Cu-seokset ja muut järjestelmät, joita käytetään hypertermiaan – syöpäkudosten tarkoitukselliseen lämmittämiseen indusoidulla magneettikentällä. Tämäntyyppiset seokset on suunniteltu siten, että niiden lämpövaste sähkömagneettisessa kentässä on hyvin hallittavissa, mikä mahdollistaa lämpöenergian tarkan toimittamisen kasvaimeen.
Metallisten implanttien korroosio biologisessa ympäristössä
Korroosio on keskeinen ilmiö metallisissa biomateriaaleissa. Kehossa on kyse ionia (Na⁺, Cl⁻, HCO₃⁻, fosfaatteja) sisältävästä elektrolyyttinesteestä, vaihtelevasta pH-arvosta ja eri alueiden välisistä potentiaalieroista – kaikki nämä tekijät edistävät sähkökemiallisia reaktioita.
Pourbaix-diagrammeja, jotka esittävät sähkökemiallisen potentiaalin ja pH:n välisen suhteen, käytetään kuvaamaan metallien stabiilisuutta. Niissä erotetaan toisistaan korroosioalueet (aktiivisuus), passiiviset alueet ja immuniteettialueet. Ihmiskehossa eri nesteillä on erilaiset pH- ja happipitoisuustasot: kudosnesteen pH on yleensä noin 7,4, mutta haavan läheisyydessä se voi laskea jopa 3,5:een ja tulehtuneessa haavassa nousta 9,0:aan. Tämä tarkoittaa, että metalli, joka toimii hyvin yhdessä kehon osassa, voi korrodoitua toisessa.
Pourbaix-diagrammeilla on kuitenkin rajoituksia – ne perustuvat tasapainotiloihin yksinkertaisessa metalli-vesi-reaktiotuotteiden järjestelmässä. Kloridi-ionien tai monimutkaisten orgaanisten molekyylien läsnäolo voi muuttaa metallin käyttäytymistä merkittävästi, ja ennustettu passiivisuus voi käytännössä osoittautua liian optimistiseksi. Siksi näiden kaavioiden lisäksi käytetään polarisaatiokäyriä, joiden avulla voidaan määrittää korroosiovirta ja sen perusteella laskea kudoksiin vapautuvien ionien määrä ja materiaalin häviämisnopeus. Vaihtoehtoisesti mitataan näytteen massan häviö altistuksen aikana kehon nesteitä vastaavassa liuoksessa.
Implanttimateriaalien korroosio voi ilmetä eri muodoissa. Tasainen korroosio johtaa suhteellisen homogeeniseen materiaalin menetykseen, mutta paikalliset muodot ovat paljon vaarallisempia. Pistekorroosio aiheuttaa syviä, paikallisia menetyksiä – ruostumattomat teräkset ovat erityisen alttiita tälle kloridien läsnä ollessa. Rakokorroosio esiintyy alueilla, joihin happea pääsee rajoitetusti, kuten ruuvin ja levyn välisissä raoissa, joissa paikalliset kemialliset olosuhteet (pH, ionipitoisuus) eroavat merkittävästi ympäröivästä ympäristöstä. Hionta on korroosiota, joka liittyy kahden kosketuspinnan mikroliikkeisiin – mekaaninen kuluminen tuhoaa passiivisen kerroksen, paljastaen uuden metallin ja kiihdyttäen korroosiota.
Jännityskorroosio ja väsymiskorroosio ovat erityisiä korroosion muotoja. Mekaanisten rasitusten, erityisesti toistuvien rasitusten, vaikutuksesta korroosionopeus voi kasvaa ja mikrohalkeamat voivat levitä nopeammin. Esimerkiksi ruostumattomasta teräksestä valmistetuissa implantteissa on havaittu lonkkapulttien ja -nastojen murtumia, kun taivutuskuormitukset ja aggressiivinen fysiologinen ympäristö ovat esiintyneet samanaikaisesti. Tällaisissa tapauksissa on vaikea puhua ”puhtaasta” korroosiosta – kyseessä on aina kemian, mekaniikan ja mikrorakenteen dynaaminen vuorovaikutus.
Eri metallit käyttäytyvät tässä suhteessa eri tavoin. Jalometallit, kuten kulta, ovat käytännössä korroosionkestäviä – niiden standardi sähkökemiallinen potentiaali on positiivinen, ja Pourbaix-diagrammeissa ne sijaitsevat immuniteettialueella. Titaani- ja Co–Cr-seokset perustuvat passiivisuuteen – ne muodostavat hyvin tarttuvan, tiiviin oksidikerroksen, jonka ansiosta niiden korroosiovirrat ovat hyvin alhaiset ja pinta pysyy vakaana. Ruostumattomat teräkset hyötyvät myös kromin passiivisuudesta, mutta niiden passiivinen kerros on vähemmän vakaa, mikä tekee niistä alttiimpia piste- ja rakkokorroosiolle. Hammasamalgaami puolestaan on termodynaamisesti osittain passiivinen, mutta käytännössä se on erittäin korroosiolle altis materiaali, erityisesti biofilmin läsnä ollessa.
Metallisten implanttien valmistus ja käsittely
Metallisten implanttien valmistuksessa ei ole kyse vain geometrian muotoilusta, vaan myös mikrorakenteen ja pinnan kunnon hallinnasta, jotka määräävät väsymislujuuden, korroosionkestävyyden ja biologisen reaktion.
Ruostumattomien terästen tapauksessa on ratkaisevan tärkeää, että austeniittiset teräkset kovettuvat hyvin nopeasti puristuksen alaisena. Tämä tarkoittaa, että kylmämuovauksen (valssaus, vetäminen, taivuttaminen) aikana niiden lujuus kasvaa, mutta samalla niiden plastisuus heikkenee. Vaaditun muovattavuuden palauttamiseksi käytetään välilämmitystä, jossa on vältettävä lämpötiloja ja aikoja, jotka edistävät kromikarbidien saostumista raerajoille, mikä heikentää korroosionkestävyyttä. Muovauksen jälkeen komponentit puhdistetaan, hapettuvat (kemiallisesti tai hankaavasti) ja passivoidaan, yleensä typpihappoliuoksessa ASTM F86 -standardin mukaisesti.
Co-Cr-seokset käyttäytyvät eri tavalla – ne ovat erittäin alttiita vahvistumiselle muodonmuutoksen aikana, mikä monissa tapauksissa vaikeuttaa perinteistä taontaprosessia. Siksi geometrisesti monimutkaiset komponentit, kuten proteesien päät ja kupit, valmistetaan usein tarkkuusvalulla (ns. kadonneen vahan menetelmällä). Prosessissa valmistetaan tarkka vahamalli, peitetään se tulenkestävällä materiaalilla, poltetaan vaha pois ja kaadetaan nestemäinen Co-CrMo-seos muottiin korkeassa lämpötilassa. Muotin lämpötila ja jäähdytysaika vaikuttavat raekokoon sekä karbidien kokoon ja jakautumiseen – hieno mikrorakenne lisää lujuutta, mutta voi heikentää murtumiskestävyyttä, kun taas suuremmat rakeet ja karbidit parantavat sitkeyttä lujuuden kustannuksella. Suunnittelijan on siksi löydettävä kompromissi lujuuden ja murtumiskestävyyden välillä.
Titaaniseoksille valuprosessit, taontaprosessit, lämpökäsittelyprosessit sekä pintakäsittelyprosessit ovat ratkaisevan tärkeitä. Titaani vaatii suojaavan ilmakehän korkean lämpötilan prosessoinnin aikana, koska se reagoi helposti hapen ja typen kanssa muodostaen hauraita pintakerroksia. Alustavan mekaanisen prosessoinnin jälkeen titaanisten implanttien pinnat hiekkapuhalletaan, etsataan hapolla, anodisoidaan tai näiden prosessien yhdistelmällä, mikä tuottaa suotuisan mikrometrin karheuden ja muokatun oksidikerroksen. Tutkimukset osoittavat, että tällä tavalla valmistellut pinnat edistävät luun nopeampaa kasvua ja vahvan mekaanisen ja mahdollisesti kemiallisen sidoksen muodostumista.
Muodonmuistiseosten valmistusprosessit muodostavat erillisen luokan. Niiden tapauksessa on ratkaisevan tärkeää tarkasti hallita kemiallista koostumusta ja lämpökäsittelyä, jotka määräävät martensiittisen muutoksen lämpötilat ja superelastisuuden alueen. NiTi-stenttien tai ortodontisten kaarien on saavutettava haluttu muodonmuutos ja palaututtava muotoonsa tarkasti määritellyllä lämpötila-alueella, mukaan lukien fysiologiset olosuhteet.
Yhteenveto – Metalliset biomateriaalit
Metalliset biomateriaalit muodostavat laajan ryhmän, jossa jokaisella materiaalilla on oma, melko tarkasti määritelty toiminnallinen markkinarako. Ruostumattomat teräkset, erityisesti tyyppi 316L, ovat suhteellisen edullisia ja helposti työstettäviä materiaaleja, joilla on hyvät mekaaniset ominaisuudet ja riittävä korroosionkestävyys, minkä vuoksi niitä käytetään pääasiassa väliaikaisissa implantteissa ja vähemmän kriittisissä komponenteissa. Co-Cr-seokset tarjoavat erittäin korkean lujuuden, kovuuden ja kulutuskestävyyden, minkä vuoksi ne ovat ensisijainen materiaali proteesikuppien ja -päiden sekä varren valmistuksessa, joissa kestävyys raskaiden kuormitusten alla on tärkeää. Titaani ja sen seokset, joissa yhdistyvät erittäin hyvä korroosionkestävyys, suotuisa kimmokerroin ja korkea biologinen yhteensopivuus, ovat tulleet pitkäaikaisten implanttien, erityisesti ortopedian ja hammasimplantologian, ”kultaiseksi standardiksi”.
Erityiset metalliseokset, kuten muotomuistilla varustettu NiTi, ovat myös tärkeässä roolissa, sillä ne mahdollistavat täysin uusia hoitostrategioita – itsestään laajenevista stentteistä superelastisiin ortodonttisiin kaarteisiin. Kulta ja amalgaamit ovat edelleen tärkeitä hammaslääketieteessä, vaikka niiden käyttöä tarkistetaankin esteettisten ja turvallisuusvaatimusten perusteella.
Kaikkien metallisten biomateriaalien yhteinen nimittäjä on tarve hallita korroosiota ja kudosten vuorovaikutusta. Pourbaix-diagrammit, polarisaatiokäyrät, väsymistestit ja ionien toksisuustutkimukset muodostavat perustan näiden materiaalien tekniselle suunnittelulle. Pintatekniikka on yhtä tärkeää – se määrää passiivisen kerroksen laadun, kulutuskestävyyden, solujen tarttuvuuden ja luun kanssa muodostuvan sidoksen luonteen.
Tämän seurauksena moderni biomateriaalitekniikka ei tarkastele metalleja erillisinä, vaan käsittelee niitä osana monimutkaisia järjestelmiä: metallinen ydin voidaan päällystää bioaktiivisella keramiikalla, ympäröidä polymeerikomposiitilla tai yhdistää huokoisiin keraamisiin rakenteisiin, jotka tukevat uudistumista. Metallit tarjoavat kantavuutta ja plastisuutta, keraamit bioaktiivisuutta ja kulutuskestävyyttä ja polymeerit joustavuutta ja kykyä muodostaa pehmeitä rakenteita. Yhdessä ne muodostavat modernin implantologian perustan, jossa tavoitteena ei ole enää pelkästään ”osien korvaaminen”, vaan toiminnallisen, biologisesti integroidun elimen rekonstruoinnin saavuttaminen.