Legierungselemente in Eisen-Kohlenstoff-Legierungen

Inhaltsverzeichnis
Kohlenstoffstähle lassen sich über Wärmebehandlung in einem breiten Spektrum einstellen. In vielen technischen Anwendungen stößt dieses Spektrum jedoch an Grenzen. Sobald höhere Festigkeiten, bessere Durchhärtbarkeit, höhere Warmfestigkeit oder besondere Funktionsmerkmale gefragt sind, reicht das Zusammenspiel aus Eisen und Kohlenstoff allein häufig nicht mehr aus. Genau hier setzen legierte Stähle an: Durch die gezielte Zugabe weiterer Elemente oder durch eine bewusste Anhebung ohnehin vorhandener Begleitstoffe wie Mangan und Silizium entsteht eine Werkstoffgruppe, deren Leistungsprofil sich deutlich weiter ausdehnen lässt.
Legierungszusätze wirken nicht isoliert. Sie greifen gleichzeitig in das Verhältnis von Eisen und Kohlenstoff ein und beeinflussen sich auch gegenseitig. Das Ergebnis sind veränderte Gleichgewichte, andere Umwandlungswege und neue Ausscheidungszustände. Auf dieser Grundlage lassen sich Eigenschaften realisieren, die mit unlegierten Stählen kaum erreichbar sind: höhere Festigkeiten bei gleichzeitig besserer Zähigkeit, gesteigerte Härtbarkeit, erhöhte Verschleißbeständigkeit und, je nach System, funktionale Spezialmerkmale wie Korrosions– oder Hochtemperaturbeständigkeit.
Der Preis dafür ist offensichtlich: Legierte Stähle sind in der Regel teurer und werden deshalb dort eingesetzt, wo Kohlenstoffstahl die Anforderungen nicht mehr erfüllt. Hinzu kommt ein zweiter praktischer Punkt: Viele Effekte der Legierung zeigen sich erst im wärmebehandelten Zustand. Die Legierung verändert die Kinetik der Austenitumwandlung, beeinflusst das Kornwachstum, ermöglicht die Bildung und Stabilisierung von Legierungskarbiden und erweitert die Bandbreite sinnvoller Kombinationen aus Härte und Plastizität. Ohne geeignete Austenitisierung, Abkühlführung und Anlassen bleibt ein Teil dieses Potenzials ungenutzt.
Klassifizierung legierter Stähle und die Ursache ihrer Unschärfen
Legierte Stähle lassen sich nach unterschiedlichen Kriterien einteilen, am verbreitetsten ist die Klassifizierung über Art und Menge der Legierungszusätze, also über die chemische Zusammensetzung. Daraus entstehen Bezeichnungen wie Chromstähle, Manganstähle oder Chrom-Nickel-Stähle. In der Praxis wird diese Systematik jedoch zunehmend unscharf. Moderne Stähle enthalten oft mehrere wirksame Zusätze gleichzeitig, und ihr Verhalten ergibt sich aus der Kombination, nicht aus einem „Hauptelement“, das alles dominiert.
Für die Werkstoffauswahl ist daher auch die Einteilung nach Legierungsgrad wichtig: niedriglegierte, mittellegierte und hochlegierte Stähle, ergänzt um mikrolegierte Varianten bei sehr geringen Zusatzmengen. Ebenfalls praxisnah ist die Klassifikation nach Anwendung: Baustähle, Werkzeugstähle und Stähle mit besonderen Eigenschaften. Hinter dieser Einteilung steht eine einfache technische Logik. Unterschiedliche Anwendungen verlangen unterschiedliche Verfestigungsmechanismen, etwa Ausscheidungshärtung, erhöhte Härtbarkeit, Stabilität des Gefüges bei hohen Temperaturen oder definierte Karbidmorphologien. Damit verschiebt sich automatisch die Auswahl der relevanten Legierungselemente.
Kennzeichnung legierter Stähle
Das im Ausgangsmaterial beschriebene Kennzeichnungssystem verknüpft Buchstaben und Zahlen direkt mit der Zusammensetzung. Üblicherweise steht die erste Zahl für den mittleren Kohlenstoffgehalt in Hundertstel Prozent. Die Zahlen hinter den Buchstaben geben den durchschnittlichen Gehalt eines Legierungselements in Prozent an. Fehlt hinter einem Buchstaben eine Zahl, liegt der Anteil des betreffenden Elements im Regelfall unter 1,5 %. Stähle höherer Qualität, insbesondere mit sehr niedrigem Phosphor- und Schwefelgehalt, werden zusätzlich mit einem „A“ am Ende markiert.
Wichtig ist dabei ein Detail, das in der Praxis schnell übersehen wird: Die Buchstaben stammen in diesem System aus dem russischen Alphabet und entsprechen nicht automatisch den heute geläufigen chemischen Symbolen. Wer eine Kennzeichnung korrekt interpretieren will, muss deshalb die Zuordnung der Buchstaben zu den Elementen beherrschen. Das Prinzip bleibt trotzdem klar: Aus der Kennzeichnung lässt sich sowohl der Kohlenstoffgehalt als auch der Anteil der Hauptzusätze ablesen, ebenso wie die Qualitätsstufe.
Für Werkzeugstähle gilt ein anderes Schema. Hier steht am Anfang eine Buchstabengruppe, die die Funktionsklasse markiert, etwa Stähle für Kalt- oder Warmumformung sowie Schnellarbeitsstähle. Die folgenden Buchstaben und Zahlen differenzieren die wesentlichen Legierungszusätze und trennen einzelne Güten. Auch hier existiert eine festgelegte Elementzuordnung, etwa für Wolfram, Vanadium, Molybdän, Chrom oder Kobalt.
Legierungselemente und die Allotropie des Eisens
Ein zentraler Effekt der Legierung betrifft die Stabilitätsbereiche der Eisenallotrope, insbesondere den Temperaturbereich, in dem Austenit (γ-Phase) existieren kann. Legierungselemente verschieben die kritischen Umwandlungstemperaturen A₃ und A₄ und verändern damit die Größe des γ-Feldes.
Eine erste Elementgruppe senkt A₃ und erhöht A₄. Dadurch erweitert sich der Existenzbereich der γ-Phase. Bei ausreichend hohem Zusatz kann Austenit im Extremfall von Raumtemperatur bis nahe zur Schmelztemperatur stabil bleiben. Man spricht dann von einem offenen Austenitfeld. Dieser Effekt ist typisch für Systeme, die mit Eisen kontinuierliche feste Lösungen bilden, etwa bei Legierungen mit Nickel, Kobalt oder Mangan.
Komplexer wird das Bild, wenn ein Element das γ-Feld zwar erweitert, aber keine durchgehende Löslichkeit besitzt. Dann kann sich der Austenitbereich zunächst ausdehnen, später jedoch durch Zweiphasengebiete wieder verengen und im Grenzfall verschwinden. Das Ausgangsmaterial beschreibt diesen Typ als „erweitertes Austenitfeld“ und nennt dafür Beispiele, darunter bestimmte Systeme mit Kupfer oder Gold sowie den Einfluss interstitieller Elemente wie Kohlenstoff und Stickstoff.
Die zweite Gruppe wirkt gegensätzlich: Sie senkt A₄ und erhöht A₃. Bei ausreichender Löslichkeit in Eisen kann daraus ein geschlossenes Austenitfeld entstehen, begrenzt durch ein Zweiphasengebiet α + γ. Außerhalb dieses Feldes liegt Ferrit vom unteren Temperaturbereich bis zur Schmelze vor. Zu den Elementen mit dieser Tendenz gehören unter anderem Aluminium, Silizium, Titan, Vanadium, Chrom, Molybdän und Wolfram. Ist die Löslichkeit in γ zu gering, entsteht kein geschlossenes, sondern lediglich ein verengtes Austenitfeld, wie es beispielsweise für Systeme mit Bor, Zirkonium oder Cäsium beschrieben wird.

In welcher Form liegen Legierungszusätze im Stahl vor?
Die Wirkung eines Legierungselements entscheidet sich nicht nur an seiner Menge, sondern daran, wo es im Gefüge sitzt und in welcher Bindungsform es vorliegt. Grundsätzlich kommen Legierungszusätze in fester Lösung, als Karbide, als nichtmetallische Einschlüsse, als intermetallische Verbindungen oder, selten, in freier Form vor. Für die meisten praxisrelevanten legierten Stähle sind zwei Zustände jedoch entscheidend: Mischkristalle und Karbide. Sie prägen die Eigenschaften und bestimmen das Verhalten während der Wärmebehandlung am stärksten.
Nichtmetallische Einschlüsse treten typischerweise nur in geringen Mengen auf. Ihre Wirkung hängt meist mehr von Form, Größe und Verteilung ab als von der genauen Chemie. Intermetallische Verbindungen spielen eher bei sehr hohen Zusatzgehalten eine Rolle und sind in klassischen Konstruktionsstählen meist zweitrangig. Wer verstehen will, warum ein legierter Stahl besser durchhärtet, weniger überhitzt oder höhere Warmfestigkeit zeigt, muss in der Regel auf zwei Mechanismen schauen: Lösungshärtung und Legierungskarbide.
Additive in fester Lösung
Viele Legierungselemente lösen sich in Ferrit oder Austenit, allerdings in sehr unterschiedlichem Ausmaß. Ein wesentlicher Einflussfaktor ist die Atomgröße: Je stärker die Atomradien vom Eisen abweichen, desto deutlicher wird das Gitter elastisch verzerrt. Interstitielle Elemente wie Kohlenstoff, Stickstoff oder Bor folgen einer anderen Logik, weil sie Zwischengitterplätze besetzen.
Technisch zeigt sich der Effekt klar: In Ferrit gelöste Additive erhöhen Zugfestigkeit, Streckgrenze und Härte, während sie die plastischen Eigenschaften tendenziell reduzieren. Je größer die Gitterstörung, desto stärker der Härtungseffekt. Qualitativ betrachtet wirken Mangan, Silizium und Nickel deutlich härtend, während Chrom, Molybdän und Wolfram in der reinen Lösungshärtung oft weniger stark ausfallen. Für die Schlagzähigkeit ist das Bild kritischer: Viele Zusätze senken sie, Chrom und insbesondere Nickel sind hier günstiger zu bewerten. Nickel kann, je nach Gesamtsystem, Härte erhöhen, ohne die Zähigkeit im gleichen Maß zu opfern, und ist damit aus konstruktiver Sicht ein besonders wertvoller Zusatz.
Ein weiterer Punkt ist prozessabhängig: Bei Ferrit, das Nickel, Chrom oder Mangan in Lösung enthält, kann schnelle Abkühlung eine nadelige Struktur begünstigen, die optisch an martensitische Gefüge erinnert und die Härte gegenüber langsamer Abkühlung deutlich anheben kann. Bei Ferrit mit Silizium, Molybdän oder Wolfram ist diese Abhängigkeit wesentlich schwächer. Damit wird eine zentrale Wahrheit sichtbar: Gleiche Zusammensetzung garantiert keine gleiche Härte, wenn Abkühlführung und Kinetik nicht mitgedacht werden.
Legierungskarbide
In vielen legierten Stählen ist nicht die feste Lösung der dominierende Hebel, sondern das Karbidsystem. Die Neigung zur Karbidbildung hängt mit der elektronischen Struktur der Elemente zusammen. Praktisch lässt sich eine Reihenfolge zunehmender Karbidstabilität formulieren: Fe, Mn, Cr, Mo, W, V, Ti, Zr, Nb. Je stabiler ein Karbid ist, desto höher liegt die Temperatur, bei der es sich beim Austenitisieren löst. Gleichzeitig wird es beim Anlassen schwerer aus dem Martensit auszutreiben. Genau deshalb beeinflussen karbidbildende Zusätze direkt die Wahl von Austenitisierungs- und Anlasstemperaturen: Wer die Karbide nicht ausreichend löst, verändert nicht nur die Ausgangszusammensetzung des Austenits, sondern auch die spätere Umwandlungskinetik.
Das Ausgangsmaterial verweist auf Goldschmidts Klassifikation nach Karbidtypen. Karbide der Gruppe I besitzen ein NaCl-ähnliches Gitter und die Formel MC, etwa TiC, ZrC, VC oder NbC. Sie sind extrem stabil und sehr hart. Gruppe II umfasst Karbide mit dicht gepacktem hexagonalem Gitter, häufig vom Typ MC oder M₂C, etwa WC, W₂C oder MoC, mit etwas geringerer, aber weiterhin sehr hoher Stabilität. Gruppe III umfasst M₃C-Karbide mit Zementitstruktur, darunter Fe₃C und Mn₃C, deren Härte und Stabilität unter den Gruppen I und II liegen.
In realen Stählen treten Karbide selten als „reine“ Verbindungen auf. Eisen ist oft mitgelöst, und bei mehreren Zusätzen entstehen Mischkarbide. Karbide mit ähnlicher Struktur können ineinander löslich sein, etwa Zementit und Mangankarbid. Hinzu kommen komplexere Karbidtypen wie M₂₃C₆ oder M₇C₃. Technologisch ist der Unterschied entscheidend: Einfache, sehr stabile Karbide wie MC oder M₂C lösen sich auch bei hohen Temperaturen nur begrenzt. Komplexe Karbide können bei Erwärmung dagegen deutlich leichter in Austenit übergehen. Damit verschiebt sich das Prozessfenster, und es steigt die Bedeutung einer präzisen Temperatur- und Zeitführung.
Karbidbildner und Nicht-Karbidbildner
Eine praxisnahe Einteilung folgt der Wechselwirkung mit Kohlenstoff. Nicht karbidbildende Elemente wie Nickel, Silizium, Kobalt, Aluminium, Kupfer und in gewisser Weise auch Stickstoff liegen im Stahl überwiegend in fester Lösung vor. Es gibt Ausnahmen: Kupfer kann bei höheren Gehalten als eigenständige Phase auftreten, und Stickstoff kann Nitridbildungen ermöglichen.
Karbidbildende Elemente sind dagegen „doppelt präsent“. Sie können sowohl in fester Lösung als auch als Karbide auftreten. Welche Form dominiert, hängt vom Kohlenstoffgehalt und von der Konkurrenz anderer Karbidbildner ab. Bei hohem Kohlenstoffgehalt und wenigen Karbidbildnern werden diese Elemente bevorzugt in Karbiden gebunden. Bei niedrigem Kohlenstoffgehalt und hohem Karbidbildnergehalt ist der Kohlenstoff schnell „verbraucht“, verbleibende Anteile der Zusätze bleiben in Lösung. Welche Elemente zuerst in Karbiden landen, entscheidet ihre Affinität zu Kohlenstoff.
Für die Eigenschaftsbildung ist eine Bewertung entscheidend: Karbide wirken im Allgemeinen deutlich stärker als reine Lösungshärtung. Ihre „Kraft“ hängt jedoch weniger von der chemischen Formel ab als von Dispersion und Morphologie. Grobe Karbidpartikel verstärken schwach, plattenförmige Ausscheidungen beeinträchtigen die Plastizität stärker als kugelige, und Karbide an Korngrenzen können Sprödigkeit und Rissanfälligkeit drastisch erhöhen. Wer Karbide einsetzt, muss daher nicht nur „Karbid haben“, sondern Karbid kontrollieren.
Veränderungen des Fe–Fe₃C-Systems durch Legierungszusätze
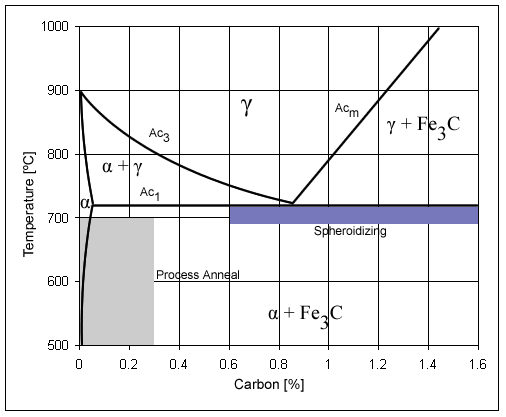
Legierungszusätze verschieben die charakteristischen Punkte und Temperaturen des Eisen-Zementit-Systems. Elemente, die das γ-Feld erweitern, senken typischerweise Ac₃. Elemente, die Austenit verengen, erhöhen Ac₃, besonders deutlich bei niedrigem Kohlenstoffgehalt. Ein ähnlicher Trend zeigt sich, bis zu einem gewissen Grad, auch bei der eutektoiden Umwandlung, da auch hier allotrope Prozesse des Eisens eine Rolle spielen.
Besonders folgenreich ist der Einfluss auf die Kohlenstoffkonzentration am Eutektoidpunkt und auf die Löslichkeitsgrenze des Kohlenstoffs in Austenit. Das Ausgangsmaterial betont, dass Legierungselemente den Perlitpunkt S in Richtung niedrigerer Kohlenstoffgehalte verschieben. Der „Legierungsperlit“ entsteht damit bei geringerem Kohlenstoffgehalt als im unlegierten System. Auch der Punkt E, der die Kohlenstofflöslichkeit in Austenit begrenzt, wird meist nach links verschoben. Als besonders wirksam werden unter anderem Wolfram, Silizium, Chrom, Molybdän, Vanadium und Titan genannt. Wird diese Verschiebung groß genug, können selbst bei Kohlenstoffgehalten unter 2 % ledeburitische Strukturen auftreten. Spätestens an diesem Punkt wird klar: Das einfache Fe–Fe₃C-Diagramm reicht für legierte Systeme nicht mehr als alleinige Prognosegrundlage aus.
Methodisch folgt daraus eine klare Konsequenz: Je mehr Zusätze und je höher ihre Gehalte, desto stärker verändern sich Gleichgewichte und Umwandlungstemperaturen. Mehrkomponentencharakter ist keine Randnotiz, sondern der Normalfall, sobald es um moderne legierte Stähle geht.
Einfluss auf CTPi-Diagramme und die Wärmebehandlungspraxis
Für die Wärmebehandlung ist besonders relevant, wie Legierungszusätze die Umwandlungen von unterkühltem Austenit in CTPi-Diagrammen verschieben. Nicht karbidbildende Elemente ändern die Form der Start- und Endkurven häufig nur wenig, verschieben sie aber nach rechts. Praktisch bedeutet das: Unterkühlter Austenit bleibt länger stabil, Umwandlungen laufen langsamer ab, die Härtbarkeit steigt. Eine wichtige Ausnahme kann Kobalt darstellen, das je nach System eher beschleunigend wirken kann.
Karbidbildner beeinflussen das Bild meist stärker und komplexer, vor allem bei höheren Kohlenstoffgehalten. Typisch ist eine deutliche Verzögerung der Perlitumwandlung. Häufig steigt auch die Temperatur, bei der perlitische Umwandlungsraten ihr Maximum erreichen, wobei Mangan hier eine Sonderrolle einnehmen kann. Zugleich wird die obere Temperaturgrenze der bainitischen Umwandlung meist abgesenkt, und auch Bainit verschiebt sich, allerdings oft weniger ausgeprägt als die Perlitreaktion. Dadurch können Bereiche, die im unlegierten Stahl überlappen, in legierten Systemen auseinandergezogen werden. Bei höheren Legierungsgraden können sogar zwei getrennte Umwandlungsmaxima auftreten, getrennt durch einen Bereich besonders hoher Austenitstabilität.
Ein Punkt ist dabei nicht verhandelbar: Die Wirkung karbidbildender Zusätze hängt davon ab, ob sie während der Austenitisierung tatsächlich in den Austenit übergehen. Erhöhte Austenitstabilität entsteht nur, wenn die Zusätze gelöst vorliegen. Bleiben sie als ungelöste Karbide zurück, kann sich der Effekt umkehren. Der Austenit wird ärmer an Kohlenstoff und Legierungselementen, während die Karbide als Keime wirken und Umwandlungen sogar beschleunigen können. Genau deshalb sind bei legierten Stählen Austenitisierungstemperatur und Haltezeit nicht bloß Parameter, sondern der Schlüssel zur reproduzierbaren Gefügeentwicklung.
Legierungselemente in Eisen-Kohlenstoff-Legierungen: Zusammenfassung
Legierungselemente sind in Fe-C-Stählen kein dekorativer Zusatz zur Zusammensetzung, sondern ein Instrument der Strukturkontrolle. Ihre Wirkung entfaltet sich auf drei miteinander verknüpften Ebenen:
Gleichgewicht und Austenitstabilität: Zusätze verschieben Umwandlungstemperaturen und verändern das γ-Feld. Je nach System kann daraus ein offenes, geschlossenes oder verengtes Austenitfeld entstehen. Kinetik und Härtbarkeit: Zusätze verlangsamen Umwandlungen, verschieben CTPi-Diagramme, verändern das Verhältnis von Perlit zu Bainit und senken häufig die kritische Abkühlgeschwindigkeit, was die Durchhärtbarkeit verbessert. Mikrostruktur und Eigenschaftsaufbau: Lösungshärtung spielt eine Rolle, dominanter sind jedoch Legierungskarbide. Sie ermöglichen starke Verfestigung, beeinflussen Kornwachstum, steuern Anlasseffekte und können sekundäre Härte begünstigen.
In der Praxis entscheidet nicht allein, welche Elemente vorhanden sind, sondern in welcher Form sie vorliegen und wie sie verteilt sind. Ob Zusätze im Austenit gelöst sind oder als Karbide zurückbleiben, ob Karbide fein dispergiert oder grob ausgeschieden sind, und ob die Wärmebehandlung diese Zustände gezielt herstellt, bestimmt letztlich den Werkstoffnutzen. Erst eine konsistente Betrachtung von Gleichgewicht, Kinetik und Mikrostruktur erschließt das Potenzial legierter Stähle wirklich.