Sisteme de echilibru de fază ale aliajelor
Cuprins
În cazul metalelor pure, procesul de transformare este de obicei ușor de înțeles: topirea și solidificarea au loc la o singură temperatură precis definită, la fel ca și unele transformări structurale în stare solidă. Curbele de răcire prezintă apoi pauze caracteristice, deoarece energia este absorbită sau eliberată pentru transformarea propriu-zisă, mai degrabă decât pentru schimbarea de temperatură. În cazul aliajelor, situația nu mai este atât de „punctuală”. Se întâmplă adesea ca un aliaj să înceapă să se solidifice la o anumită temperatură, dar să se termine la o altă temperatură, iar în timpul procesului să coexiste faze cu compoziții variabile.
De aceea, în știința materialelor se utilizează diagramele de echilibru de fază, cunoscute și sub denumirea de diagrame de fază. O astfel de diagramă poate fi tratată ca o hartă: ea arată care faze sunt stabile în funcție de temperatură și compoziție și în ce ordine au loc transformările în timpul încălzirii și răcirii. Acest lucru face posibilă prezicerea atât a cursului cristalizării, cât și a transformărilor ulterioare în stare solidă și, în consecință, a structurii și proprietăților aliei finite.
Concepte cheie: sistem, fază și componente
Pentru a citi corect diagramele de echilibru, trebuie să înțelegeți limbajul pe care îl „vorbesc”. În termeni termodinamici, un sistem este un fragment separat al realității analizat în condiții date, de exemplu, o probă de aliaj pe care o răcim. O fază înseamnă o parte omogenă a unui sistem cu proprietăți identice și o compoziție chimică constantă, separată de alte faze printr-o graniță de fază. O fază poate fi un lichid, o soluție solidă sau o fază intermetalică specifică, dacă se formează una.
Constituenții, adică substanțele (de obicei elemente) care alcătuiesc aliajul și din care se pot forma faze, sunt de asemenea importanți. În contextul diagramelor binare, ne referim de obicei la un sistem compus din două componente ale căror proporții variază în aliaj. În practică, aceasta înseamnă că diagrama nu descrie un singur „material”, ci mai degrabă o întreagă familie de aliaje cu compoziții diferite, iar fiecare schimbare în compoziție ne mută într-un loc diferit pe harta fazelor.
Regula fazelor Gibbs
Unul dintre motivele pentru care comportamentul aliajelor diferă de cel al metalelor pure este numărul de variabile care „controlează” sistemul. Regula fazelor lui Gibbs organizează relația dintre numărul de componente, numărul de faze și numărul de grade de libertate. În practica metalurgică, se presupune adesea o presiune constantă, deoarece efectul acesteia asupra tranzițiilor de fază ale metalelor este de obicei mic în comparație cu efectul temperaturii și al compoziției.
În practică, acest lucru înseamnă că, dacă sistemul are o „marjă de manevră” redusă, tranziția trebuie să aibă loc la o singură temperatură (de aici și opririle caracteristice). Cu toate acestea, atunci când există variabilitate în compoziție și posibilitatea coexistenței mai multor faze, sistemul poate trece prin zone în care două faze apar simultan, iar compozițiile lor se modifică odată cu temperatura. Apoi, solidificarea sau transformările în stare solidă se extind pe un anumit interval de temperatură, iar structura se formează în etape.
Cum se creează un diagramă de echilibru binar?
Un diagramă binară tipică arată relația dintre temperatură și compoziția chimică. Axa orizontală reprezintă compoziția aliajului (de exemplu, procentul unui component), iar axa verticală reprezintă temperatura. Pentru a construi o astfel de diagramă, se efectuează o serie de experimente pentru mai multe aliaje cu proporții diferite de componente și se înregistrează temperaturile la care au loc transformările – cel mai adesea prin metode de analiză termică, bazate pe curbe de răcire și încălzire.
Limitele zonelor de fază sunt deosebit de importante în grafic. O linie numită liquidus separă zona complet lichidă de zona în care lichidul coexistă cu faza solidă. Linia solidus marchează limita sub care aliajul este complet solid. Între liquidus și solidus, există de obicei o zonă de amestec (de exemplu, fază lichidă + fază solidă), ceea ce înseamnă, în practică, că în timpul răcirii, aliajul trece printr-o etapă în care o parte din material este deja solidă, iar o parte rămâne lichidă.
De asemenea, este important modul în care se interpretează compoziția fazelor la o temperatură dată. Acest lucru se realizează trasând o linie orizontală (izotermă) prin grafic: intersecția cu liquidus indică compoziția lichidului, iar intersecția cu solidus indică compoziția fazei solide în echilibru la temperatura respectivă. Aceasta este baza pentru a deduce ce se întâmplă de fapt în aliaj în timpul răcirii.
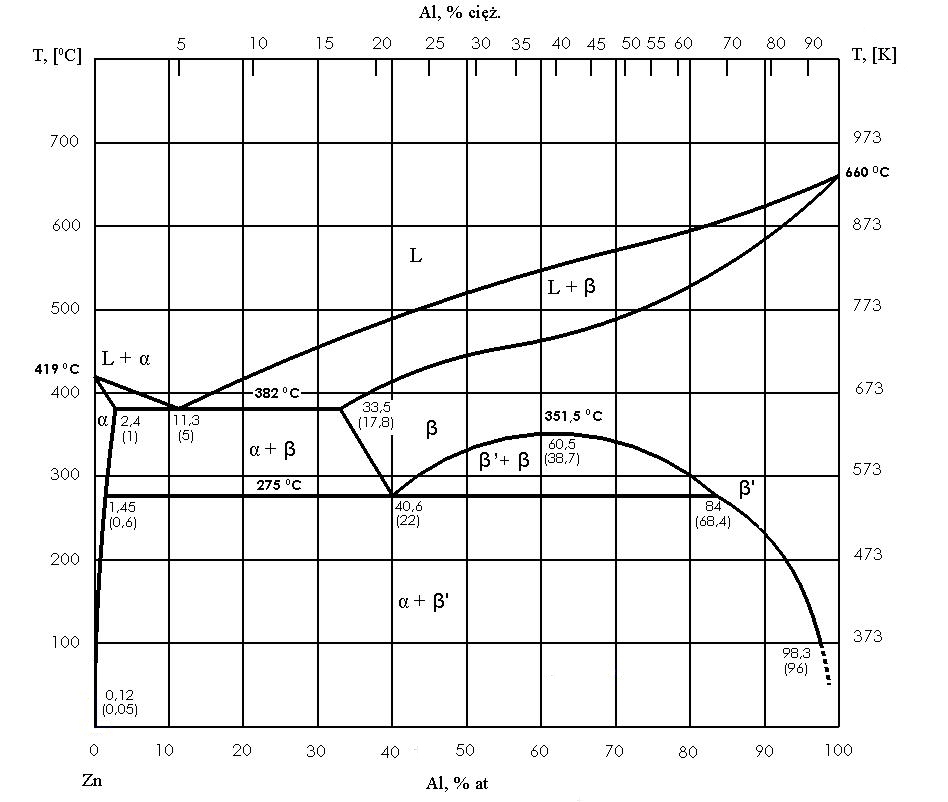
Cele mai importante tipuri de sisteme de echilibru
Soluție solidă continuă
În unele sisteme, componentele se amestecă liber între ele atât în stare lichidă, cât și în stare solidă. În acest caz, sub solidus, există o singură fază – o soluție solidă cu o compoziție care depinde de poziția pe axa compoziției. În timpul răcirii, aliajul începe să se solidifice la liquidus când apar primele cristale ale soluției solide și se termină la solidus când dispare ultima porțiune de lichid. Acesta este un exemplu clasic de solidificare într-un interval de temperatură, fără o singură oprire.
Este important de menționat că în zona „soluție lichidă + solidă”, compozițiile ambelor faze sunt diferite și se modifică în funcție de temperatură. Citirea izotermei ne permite să determinăm care parte a aliajului se află deja în stare solidă la un moment dat și care parte este încă lichidă.
Eutectic
Un sistem eutectic este foarte caracteristic atunci când componentele se amestecă într-un lichid, dar se dizolvă slab sau deloc în stare solidă. În acest caz, există o compoziție eutectică și o temperatură la care un lichid omogen se transformă în două faze solide simultan. O astfel de transformare este izotermică, astfel încât există o pauză clară pe curba de răcire, ca în cazul metalului pur, dar mecanismul este diferit: în loc de o singură fază solidă, se formează un amestec fin de două faze, de obicei cu o morfologie specifică, regulată.
Aliajele cu o compoziție diferită de cea eutectică formează o structură mixtă. Dacă aliajul este hipereutectic, cristalele primare ale unei faze sunt separate mai întâi, iar abia apoi restul lichidului se solidifică ca eutectic. Dacă aliajul este hipereutectic, cristalele primare ale celei de-a doua faze apar mai întâi, urmate de cele eutectice. Ca rezultat, microstructura depinde de compoziție: eutecticul poate domina, cristalele primare pot domina sau ambele componente pot avea proporții similare.
Eutectic cu solubilitate limitată în stare solidă
În practică, se întâlnește adesea o situație intermediară: componentele se amestecă bine în stare lichidă, dar în stare solidă formează soluții solide numai într-o măsură limitată. Apoi, în loc de faze „pure”, se formează soluții solide de graniță, denumite în mod obișnuit α și β, iar eutecticul devine un amestec al acestor două soluții cu compoziții saturate la temperatura eutectică.
Acest lucru este foarte important deoarece, odată cu răcirea suplimentară, solubilitatea în stare solidă scade adesea, astfel încât soluțiile α și β pot deveni suprasaturate. Ca urmare, după finalizarea solidificării pot apărea separări secundare și o „maturizare” suplimentară a structurii. Diagrama nu este, așadar, doar o descriere a cristalizării, ci și un ghid al schimbărilor din starea solidă care afectează proprietățile materialului.
Peritectică
În sistemele peritectice, are loc o transformare în care lichidul reacționează cu faza solidă existentă pentru a forma o nouă fază solidă. Acest lucru se produce la o temperatură specifică, deoarece în momentul reacției coexistă trei faze. Mecanismul peritectic are o importanță practică, deoarece noua fază crește adesea pe cristalele fazei originale, formând un strat care împiedică difuzia ulterioară a componentelor. Acest lucru poate determina devierea cursului real al transformării de la echilibrul ideal, în special în cazul răcirii mai rapide.
Din punct de vedere tehnologic, peritectica poate fi o sursă de eterogenitate și structuri care depind nu numai de diagrama de echilibru în sine, ci și de cinetică, adică de viteza proceselor de difuzie. Prin urmare, atunci când se interpretează diagramele, este important să se țină cont de faptul că diagrama descrie echilibrul și nu întotdeauna starea reală „în timp real”, fără a se acorda timp compoziției să se echilibreze.
Solubilitate limitată în lichid
Uneori, chiar și în stare lichidă, sistemul nu este complet omogen. Se poate întâmpla ca, într-un anumit interval de temperatură, lichidul să se separe în două lichide cu compoziții diferite, ceea ce favorizează segregarea și formarea de zone cu proprietăți diferite. Într-un astfel de sistem, este posibilă o transformare monotectică, în care un lichid se transformă într-un alt lichid și într-o fază solidă.
Din punctul de vedere al tehnologiei de turnare, acest lucru este important deoarece separarea lichidelor poate duce la o eterogenitate nedorită a aliajului. În practică, acest lucru este adesea contracarat prin controlul adecvat al procesului, inclusiv selectarea vitezei de răcire sau a metodei de amestecare a metalului lichid, pentru a limita timpul de dezvoltare a segregării.
Compuși chimici și faze intermetalice
În multe sisteme se formează compuși chimici și faze intermetalice. Dacă un compus are o compoziție stoichiometrică constantă, acesta apare în diagramă ca o poziție caracteristică corespunzătoare acestei proporții de componente. Un astfel de compus se poate topi într-un mod „asemănător metalului pur” atunci când se transformă într-un lichid cu aceeași compoziție, sau se poate forma și dispărea în transformări peritectice atunci când procesul se desfășoară prin reacție cu lichidul.
Fazele intermetalice sunt adesea dure și fragile, iar prezența lor poate modifica semnificativ proprietățile aliajului. Din acest motiv, diagramele de fază sunt deosebit de importante în proiectarea aliajelor, deoarece ne permit să prevedem dacă, într-un anumit interval de compoziție și temperatură, va apărea o fază care va afecta plasticitatea sau, dimpotrivă, va întări aliajul prin precipitații fine.
Transformări în stare solidă: eutectoidă și peritectoidă
Diagramele de echilibru nu se încheie odată cu solidificarea. În multe aliaje, transformările care au loc după trecerea la starea solidă sunt importante, în special atunci când solubilitatea în soluții solide se modifică odată cu temperatura sau când unul dintre componente prezintă polimorfism. De o importanță deosebită este transformarea eutectoidă, care este echivalentă cu eutectica, dar are loc în întregime în stare solidă: o soluție solidă se descompune în două faze solide la o temperatură constantă. Această transformare duce adesea la o structură fină și regulată și poate modifica semnificativ proprietățile mecanice.
Există, de asemenea, o transformare peritectică, analogă cu peritectica, dar fără implicarea lichidului: două faze solide reacționează pentru a forma o a treia fază solidă. În practică, transformările în stare solidă pot fi cruciale, deoarece pot determina duritatea, rezistența la impact sau rezistența la fluaj, chiar dacă procesul de solidificare s-a desfășurat corect.
Semnificație practică
Cea mai importantă concluzie care rezultă din analiza diagramelor este că proprietățile aliajelor rezultă în primul rând din structura lor, și nu numai din elementele pe care le conțin. Aliajele monofazice sunt de obicei mai omogene, iar proprietățile lor se modifică adesea mai uniform odată cu compoziția. În cazul aliajelor multifazice, situația este mai complexă, deoarece comportamentul materialului este determinat de tipul fazelor, proporția acestora, distribuția, dimensiunea granulelor și morfologia (de exemplu, forma eutecticelor sau natura precipitatelor).
Prin urmare, un diagramă de fază este un instrument care ajută la corelarea condițiilor procesului cu rezultatul. Dacă știți la ce temperaturi și compoziții apar anumite faze, puteți selecta în mod conștient compoziția aliajului și condițiile de răcire și tratament termic. În practică, acest lucru înseamnă că este posibil să se prevadă dacă aliajul va avea tendința de segregare, dacă vor apărea faze intermetalice fragile, dacă precipitatele pot fi utilizate pentru întărire sau dacă structura va fi stabilă în condiții de funcționare.
Sisteme de echilibru de fază ale aliajelor – rezumat
Sistemele de echilibru de fază sunt un instrument care organizează comportamentul aliajelor în mod sistematic și previzibil. Acestea pot fi utilizate pentru a determina care faze vor fi stabile, când va începe și se va termina solidificarea, dacă vor apărea fenomene eutectice sau peritectice și ce transformări pot avea loc în stare solidă. În practică, aceasta înseamnă capacitatea de a controla microstructura și, astfel, de a controla proprietățile mecanice și fizice ale materialului. Capacitatea de a citi diagramele de fază este, prin urmare, una dintre cele mai importante abilități în știința materialelor și metalurgie, deoarece permite transpunerea teoriei transformărilor de fază în decizii inginerești reale.