Biomateriale metalice

Cuprins
Metalele joacă un rol complet diferit în ingineria biomedicală față de ceramică sau polimeri. Acestea se disting în primul rând prin proprietățile lor mecanice excelente și conductivitatea electrică și termică ridicată. Acest lucru se datorează naturii legăturii metalice – unii electroni sunt delocalizați, formând un nor de „electroni liberi” care sunt responsabili de conductivitate și de legătura puternică, deși nedirecțională, dintre ionii metalici. Această structură permite atomilor din rețeaua cristalină să se miște unul față de celălalt fără a perturba ordinea, rezultând plasticitatea caracteristică metalelor și capacitatea de a suferi deformări mari fără distrugere bruscă.
Această caracteristică este utilizată în mod conștient în biomateriale. Metalele servesc atât ca înlocuitori pasivi pentru țesuturile dure – în proteze de șold și genunchi, plăci osoase, șuruburi, cuie intramedulare, implanturi dentare – cât și ca materiale pentru dispozitive mai „active”, cum ar fi stenturi vasculare, ghidaje pentru catetere, fire ortodontice și implanturi cohleare. În aceste aplicații, nu numai rezistența contează, ci și formabilitatea, elasticitatea, conductivitatea și susceptibilitatea la fabricarea de precizie.
Istoria biomaterialelor metalice a început cu aliajele de oțel. Primul aliaj dezvoltat special pentru aplicații ortopedice a fost oțelul cu vanadiu, utilizat la fabricarea plăcilor și șuruburilor pentru fixarea fracturilor (cunoscute sub numele de plăci Sherman). De-a lungul timpului, acesta a fost înlocuit de oțeluri inoxidabile, iar mai târziu de aliaje de cobalt și crom și aliaje de titan. Aceste aliaje utilizează o serie de metale – fier (Fe), crom (Cr), cobalt (Co), nichel (Ni), titan (Ti), tantal (Ta), niobiu (Nb), molibden (Mo) și tungsten (W) – care, în doze mari, sunt toxice pentru organism, dar sub formă de aliaje stabile și rezistente la coroziune pot fi bine tolerate.
Principala provocare în utilizarea metalelor este coroziunea în mediul in vivo. Produsele coroziunii pot duce atât la slăbirea implantului în sine, cât și la reacții biologice adverse – inflamație locală, decolorarea țesuturilor, leziuni ale organelor sau răspunsuri imunitare. Prin urmare, ingineria modernă a biomaterialelor metalice se concentrează pe aliaje capabile să formeze straturi protectoare durabile și pasive la suprafață și pe modificarea conștientă a suprafeței pentru a combina rezistența bună, rezistența ridicată la coroziune și un răspuns biologic adecvat.
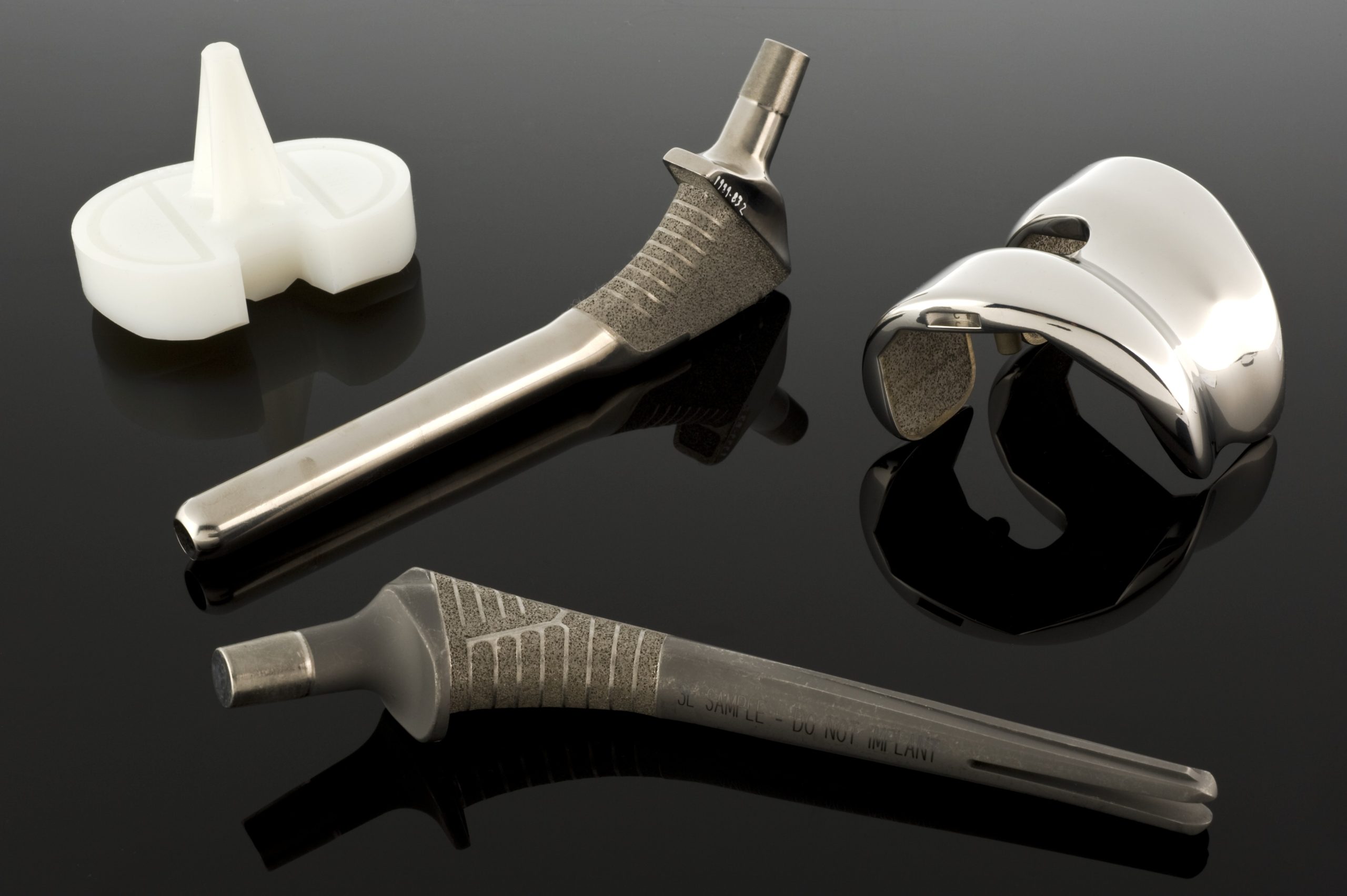
Oțelurile inoxidabile ca materiale pentru implanturi
Oțelul inoxidabil a fost unul dintre primele materiale care a înlocuit cu succes oțelul vanadiu în implanturi. Inițial, s-a utilizat oțelul 18-8 (tip 302), care conține aproximativ 18% crom și 8% nichel, cu o rezistență la coroziune semnificativ mai bună decât oțelurile clasice cu carbon. De-a lungul timpului, a apărut o variantă a oțelului 18-8 cu adaos de molibden (18-8sMo), cunoscută astăzi sub denumirea de oțel 316, urmată de o modificare cu conținut redus de carbon – oțelul 316L. Reducerea conținutului de carbon de la aproximativ 0,08% la maximum 0,03% reduce tendința de formare a carburilor de crom la granițele granulelor, ceea ce îmbunătățește rezistența la coroziune în medii bogate în cloruri, cum ar fi fluidele corporale.
Cromul este principalul responsabil pentru rezistența la coroziune a oțelurilor inoxidabile. Chiar și cu un conținut de Cr de 11%, pe suprafață se formează un strat subțire de oxid protector, conferind oțelului o stare așa-numită pasivă. Adăugarea de molibden crește rezistența la coroziunea punctiformă în medii clorurate, făcând oțelurile 316/316L mai potrivite pentru condiții fiziologice. Nichelul, la rândul său, stabilizează faza austenitică (structură γ, fcc) la temperatura camerei, făcând materialul nemagnetic și îmbunătățind rezistența sa la coroziune.
Oțelurile austenitice nu pot fi călite prin tratament termic convențional, dar răspund foarte bine la călire prin deformare. Acest lucru permite ajustarea unei game largi de proprietăți mecanice – de la structuri mai ductile și moi la structuri semnificativ călite, cu rezistență ridicată la tracțiune. Datele mecanice pentru oțelul 316L arată că, în funcție de gradul de deformare la rece, se pot obține diferite combinații de rezistență și ductilitate, ceea ce este important pentru adaptarea materialului la funcția specifică a implantului.
În ciuda numeroaselor avantaje, oțelurile 316 și 316L nu sunt materiale ideale. În condiții de solicitare ridicată, în special în zonele cu acces limitat la oxigen, cum ar fi în jurul filetelor șuruburilor sau conexiunilor plăcilor osoase, pot apărea coroziune în fisuri și coroziune punctiformă, iar pe termen lung poate apărea și coroziune de oboseală. Din acest motiv, oțelurile inoxidabile sunt utilizate cel mai frecvent în implanturile temporare, cum ar fi plăci, șuruburi, cuie și fire de fixare, care pot fi îndepărtate odată ce osul s-a vindecat. Pentru a îmbunătăți proprietățile acestora, se utilizează pe scară largă modificări ale suprafeței – de la lustruire și pasivare în acid azotic până la anodizare sau implantare de azot prin descărcare luminescentă, ceea ce crește rezistența la coroziune, uzură și oboseală.
Aliaje de cobalt și crom
Când cerințele mecanice depășesc capacitățile oțelurilor inoxidabile, intră în joc aliajele de cobalt și crom. Există două grupe principale de astfel de aliaje în biomateriale: aliajul turnat CoCrMo, utilizat, printre altele, în cupe și capete de endoproteze, și aliajul forjat CoNiCrMo, utilizat în componente cu sarcină mare, cum ar fi tijele protezelor de șold sau genunchi. Standardele ASTM descriu mai multe versiuni ale acestor materiale (F75, F90, F562, F563), dar în practica clinică predomină CoCrMo și CoNiCrMo.
Cobaltul și cromul formează o soluție solidă de până la aproximativ 65% Co, iar adăugarea de molibden determină rafinarea granulelor și, ca rezultat, creșterea rezistenței după turnare sau forjare. Cromul joacă un rol dublu: crește rezistența la coroziune prin formarea unui strat pasiv de oxid și participă la întărirea soluției. În practica clinică, aliajele Co-Cr se caracterizează printr-un modul de elasticitate foarte ridicat – în intervalul 220-234 GPa, mai mare decât al oțelurilor inoxidabile, și o rezistență foarte bună la uzură.
Cu toate acestea, această rigiditate ridicată are consecințele sale. Un implant prea rigid poate prelua o sarcină prea mare, ducând la protecția împotriva stresului – o reducere a sarcinii asupra osului propriu al pacientului și resorbția sa treptată. Deși semnificația clinică a acestui efect nu este pe deplin clară, acesta este un factor important în proiectarea și forma tijelor protetice. Pe de altă parte, duritatea și rezistența la abraziune fac din aliajele de cobalt și crom o alegere excelentă pentru perechile de frecare „metal-metal”, unde minimizarea uzurii pe termen lung este crucială. Studiile privind endoprotezele pe termen lung cu astfel de perechi indică o rată foarte scăzută de uzură liniară, de ordinul câtorva micrometri pe an.
O altă problemă importantă este eliberarea ionilor din aliajele Co-Cr și potențiala lor toxicitate. Experimentele efectuate în soluția Ringer au arătat că rata de eliberare a nichelului din aliajul CoNiCrMo și oțelul 316L este foarte similară după o anumită perioadă de timp, chiar dacă aliajul de cobalt conține de aproximativ trei ori mai mult nichel. Studiile in vitro au arătat că particulele de cobalt pot fi toxice pentru celulele care construiesc oasele, în timp ce particulele de crom și aliaj Co-Cr sunt mult mai bine tolerate. Concentrațiile ridicate de extracte de ioni Co și Ni perturbă în mod clar metabolismul celular în culturi, în timp ce ionii de crom prezintă o toxicitate mai scăzută.
Titanul și aliajele sale
Printre metalele utilizate ca biomateriale, titanul ocupă o poziție specială. În seria electrochimică, este un element „activ”, dar într-un mediu fiziologic este acoperit cu un strat de oxid pasiv foarte stabil, datorită căruia curentul său de coroziune în soluții fiziologice este extrem de scăzut, de ordinul 10⁻⁸ A/cm². În practică, implanturile din titan rămân neschimbate din punct de vedere vizual după o perioadă lungă de timp în organism.
Titanul pur (cp-Ti) și cel mai popular aliaj Ti–6Al–4V combină o rezistență foarte bună la coroziune cu un raport favorabil între rezistență și greutate. Modulul lor de elasticitate este mai mic decât cel al oțelului sau al aliajelor Co–Cr, ceea ce le apropie de os și reduce potențial riscul de protecție împotriva stresului. Pe de altă parte, titanul nu este la fel de rigid sau de rezistent la tensiune ca cele mai bune oțeluri sau aliaje de cobalt, astfel încât proiectarea elementelor portante necesită o analiză precisă a tensiunilor și, adesea, o secțiune transversală mai mare.
În ultimele decenii, au fost dezvoltate și aliaje de titan cu modul de elasticitate redus și rezistență crescută la coroziune, care conțin, printre altele, Nb și Zr, de exemplu Ti–13Nb–13Zr, concepute special pentru proteze articulare. În plus, a fost dezvoltată întărirea suprafeței aliajelor de Ti (de exemplu, tratament termochimic, nitrurare), care permite combinarea unei bune biocompatibilități a substratului cu o rezistență ridicată la uzură în zonele de frecare.
Aliajele de nichel-titan (NiTi), care prezintă memorie de formă și superelasticitate, constituie un grup special. Datorită transformării martensitice, acestea pot reproduce o formă înregistrată anterior atunci când sunt încălzite peste temperatura de transformare sau pot prezenta o deformabilitate elastică foarte mare într-un interval de tensiune îngust. Această caracteristică este utilizată, printre altele, în stenturi vasculare, arcuri ortodontice și ghidaje pentru catetere, permițând inserarea atraumatică a dispozitivelor și expansiunea lor stabilă după dilatare.
În cazul titanului, proprietățile suprafeței sunt deosebit de importante. Studiile arată că atât rugozitatea, cât și chimia suprafeței reglează comportamentul osteoblastelor și al celulelor formatoare de os – acestea afectează aderența, proliferarea și producția de factori de creștere și citokine. Tratarea chimică adecvată a suprafeței Ti și a aliajelor sale le poate face bioactive, adică capabile să formeze un strat de apatită în contact cu fluidele corporale, ceea ce favorizează legarea directă cu osul.

Metalele în stomatologie și alte aplicații speciale
Atât metalele prețioase, cât și metalele comune sunt utilizate în stomatologie. Aurul este practic rezistent la coroziune (rezistență de tip imunitate) și oferă o durabilitate excelentă și stabilitate chimică în reconstrucțiile protetice. Cu toate acestea, limitările sale sunt densitatea ridicată, rezistența insuficientă la sarcini grele și costul, ceea ce înseamnă că practic nu este utilizat în ortopedie.
Amalgamul dentar, un aliaj de argint, staniu și mercur, este utilizat în mod obișnuit. Deși fazele individuale ale acestui material sunt pasive la pH neutru, în practică, amalgamul se corodează adesea, în special în prezența diferențelor de aerare sub placa bacteriană și a microcelulelor galvanice locale. De fapt, este cel mai predispus la coroziune material utilizat în stomatologie, ceea ce se manifestă prin decolorarea și formarea de produse de coroziune pe suprafața plombelor.
Grupul metalelor speciale include, de asemenea, metalele din platină și aliajele acestora, utilizate în aplicații în care rezistența chimică și controlul conductivității sunt esențiale, precum și aliajele Ni-Cu și alte sisteme utilizate în hipertermie – încălzirea deliberată a țesuturilor canceroase folosind un câmp magnetic indus. Aceste tipuri de aliaje sunt proiectate astfel încât răspunsul lor termic într-un câmp electromagnetic să fie bine controlat, permițând furnizarea precisă a energiei termice către tumoră.
Coroziunea implanturilor metalice într-un mediu biologic
Coroziunea este un fenomen central pentru biomaterialele metalice. În organism, avem de-a face cu un fluid electrolitic care conține ioni (Na⁺, Cl⁻, HCO₃⁻, fosfați), pH variabil și diferențe de potențial între diferite zone – toți acești factori favorizează reacțiile electrochimice.
Diagramele Pourbaix, care arată relația dintre potențialul electrochimic și pH, sunt utilizate pentru a descrie stabilitatea metalelor. Acestea fac distincție între zonele de coroziune (activitate), pasivitate și imunitate. În corpul uman, diferite fluide au niveluri diferite de pH și oxigenare: fluidul tisular are de obicei un pH de aproximativ 7,4, dar în vecinătatea unei răni poate scădea până la 3,5, iar într-o rană infectată poate crește până la 9,0. Acest lucru înseamnă că un metal care funcționează bine într-o zonă a corpului poate coroda în alta.
Cu toate acestea, diagramele Pourbaix au limitări – ele se bazează pe stări de echilibru într-un sistem simplu metal-apă-produse de reacție. Prezența ionilor de clor sau a moleculelor organice complexe poate modifica semnificativ comportamentul metalului, iar pasivitatea prevăzută se poate dovedi, în practică, excesiv de optimistă. Prin urmare, pe lângă aceste diagrame se utilizează și curbe de polarizare, care permit determinarea curentului de coroziune și, pe această bază, calcularea numărului de ioni eliberați în țesuturi și a ratei de pierdere a materialului. Alternativ, se măsoară pierderea de masă a probei în timpul expunerii într-o soluție similară cu fluidul corporal.
Coroziunea materialelor implanturilor poate lua diverse forme. Coroziunea uniformă duce la o pierdere relativ omogenă de material, dar formele localizate sunt mult mai periculoase. Coroziunea punctiformă provoacă pierderi profunde și localizate – oțelurile inoxidabile sunt deosebit de sensibile la acest fenomen în prezența clorurilor. Coroziunea interstițială apare în zone cu acces limitat la oxigen, cum ar fi spațiile dintre șurub și placă, unde condițiile chimice locale (pH, concentrația ionilor) diferă semnificativ de mediul înconjurător. Frettingul este coroziunea asociată cu mișcările microscopice ale două suprafețe care intră în contact – abraziunea mecanică distruge stratul pasiv, expunând metalul proaspăt și accelerând coroziunea.
Coroziunea sub tensiune și coroziunea prin oboseală sunt forme speciale de coroziune. În prezența tensiunilor mecanice, în special a celor repetitive, rata de coroziune poate crește, iar microfisurile se pot propaga mai rapid. În cazul implanturilor din oțel inoxidabil, de exemplu, s-au observat fracturi ale șuruburilor și tijelor de șold în cazul în care au fost prezente simultan sarcini de încovoiere și un mediu fiziologic agresiv. În astfel de cazuri, este dificil să se vorbească despre coroziune „pură” – este întotdeauna o interacțiune dinamică între chimie, mecanică și microstructură.
Diferite metale se comportă diferit în acest sens. Metalele prețioase, precum aurul, sunt practic rezistente la coroziune – potențialul lor electrochimic standard este pozitiv, iar în diagramele Pourbaix ocupă zona de imunitate. Titanul și aliajele Co–Cr se bazează pe pasivitate – formează un strat de oxid bine aderent și compact, datorită căruia curenții de coroziune sunt foarte mici, iar suprafața rămâne stabilă. Oțelurile inoxidabile beneficiază, de asemenea, de pasivitatea cromului, dar stratul lor pasiv este mai puțin stabil, ceea ce le face mai susceptibile la coroziune punctiformă și interstițială. Amalgamul dentar, pe de altă parte, deși termodinamic parțial pasiv, este în practică un material foarte susceptibil la coroziune, în special în prezența biofilmului.
Fabricarea și prelucrarea implanturilor metalice
Fabricarea implanturilor metalice nu înseamnă doar modelarea geometriei, ci și controlul microstructurii și al stării suprafeței, care determină rezistența la oboseală, rezistența la coroziune și răspunsul biologic.
În cazul oțelurilor inoxidabile, este esențial ca oțelurile austenitice să se întărească foarte rapid sub compresiune. Aceasta înseamnă că, în timpul prelucrării la rece (laminare, tragere, îndoire), rezistența lor crește, dar, în același timp, plasticitatea lor scade. Pentru a restabili nivelul necesar de deformabilitate, se utilizează recoacerea intermediară, prin care trebuie evitate temperaturile și timpii care favorizează precipitarea carburilor de crom la granițele granulelor, care slăbesc rezistența la coroziune. După modelare, componentele sunt curățate, dezoxidate (chimic sau abraziv) și pasivate, de obicei într-o soluție de acid azotic, în conformitate cu ASTM F86.
Aliajele Co-Cr se comportă diferit – sunt foarte susceptibile la întărire în timpul deformării, ceea ce în multe cazuri face dificilă forjarea convențională. Prin urmare, componentele cu geometrii complexe, cum ar fi capetele și cupele protetice, sunt adesea fabricate folosind turnarea de precizie (așa-numita metodă a ceară pierdută). Procesul implică pregătirea unui model precis din ceară, acoperirea acestuia cu material refractar, arderea ceară și turnarea aliajului lichid Co-CrMo în matriță la temperatură ridicată. Temperatura matriței și timpul de răcire afectează dimensiunea granulelor și dimensiunea și distribuția carburilor – o microstructură fină crește rezistența, dar poate reduce rezistența la rupere fragilă, în timp ce granulele și carburile mai mari îmbunătățesc ductilitatea în detrimentul rezistenței. Prin urmare, proiectantul trebuie să găsească un compromis între rezistență și rezistența la rupere.
Pentru aliajele de titan, procesele de turnare, forjare și tratament termic, precum și tratamentul suprafeței, sunt cruciale. Titanul necesită o atmosferă protectoare în timpul prelucrării la temperaturi ridicate, deoarece reacționează ușor cu oxigenul și azotul, formând straturi superficiale fragile. După prelucrarea mecanică inițială, suprafețele implanturilor din titan sunt sablate, gravate cu acid, anodizate sau supuse unei combinații a acestor procese, ceea ce duce la o rugozitate micrometrică favorabilă și la modificarea stratului de oxid. Studiile indică faptul că suprafețele pregătite în acest mod favorizează o creștere mai rapidă a osului și formarea unei legături mecanice puternice și, potențial, chimice.
Procesele de fabricare a aliajelor cu memorie de formă constituie o categorie separată. În cazul acestora, controlul precis al compoziției chimice și al tratamentului termic, care determină temperaturile de transformare martensitică și intervalul de superelasticitate, este crucial. Stenturile NiTi sau arcurile ortodontice trebuie să atingă deformarea dorită și să revină la forma inițială într-un interval de temperatură strict definit, inclusiv în condiții fiziologice.
Rezumat – Biomateriale metalice
Biomaterialele metalice formează o familie extinsă, în care fiecare material ocupă propria nișă funcțională, definită destul de precis. Oțelurile inoxidabile, în special tipul 316L, sunt materiale relativ ieftine și ușor de prelucrat, cu proprietăți mecanice bune și rezistență suficientă la coroziune, motiv pentru care sunt utilizate în principal în implanturi temporare și componente mai puțin critice. Aliajele Co-Cr oferă o rezistență, duritate și rezistență la uzură foarte ridicate, ceea ce le face materialul preferat pentru cupe și capete protetice, precum și pentru tije, unde durabilitatea sub sarcini grele este importantă. Titanul și aliajele sale, combinând o rezistență foarte bună la coroziune, un modul de elasticitate favorabil și o biocompatibilitate ridicată, au devenit „standardul de aur” pentru implanturile pe termen lung, în special în ortopedie și implantologie dentară.
Aliajele speciale, precum NiTi cu memorie de formă, joacă de asemenea un rol important, permițând strategii terapeutice complet noi – de la stenturi autoexpandabile la arcuri ortodontice superelastice. Aurul și amalgamele rămân importante în stomatologie, deși aplicațiile lor sunt revizuite în lumina cerințelor estetice și de siguranță.
Numitorul comun pentru toate biomaterialele metalice este necesitatea de a controla coroziunea și interacțiunea cu țesuturile. Diagramele Pourbaix, curbele de polarizare, testele de oboseală și studiile privind toxicitatea ionică constituie baza pentru proiectarea tehnică a acestor materiale. Ingineria suprafețelor este la fel de importantă – ea determină calitatea stratului pasiv, rezistența la uzură, aderența celulară și natura legăturii cu osul.
Ca urmare, ingineria modernă a biomaterialelor nu privește metalele în mod izolat, ci le tratează ca parte a unor sisteme complexe: un miez metalic poate fi acoperit cu ceramică bioactivă, înconjurat de un compozit polimeric sau poate funcționa cu structuri ceramice poroase care susțin regenerarea. Metalele oferă capacitate de suportare a sarcinii și plasticitate, ceramica oferă bioactivitate și rezistență la abraziune, iar polimerii oferă flexibilitate și capacitatea de a forma structuri moi. Împreună, acestea constituie fundamentul implantologiei moderne, unde obiectivul nu mai este doar „înlocuirea părților”, ci realizarea unei reconstrucții funcționale și integrate biologic a organelor.



