Fase-evenwichtssystemen van legeringen
Inhoudsopgave
Bij zuivere metalen is het verloop van transformaties meestal gemakkelijk te begrijpen: smelten en stollen vinden plaats bij één enkele, nauwkeurig gedefinieerde temperatuur, net als sommige structurele transformaties in de vaste toestand. Afkoelingscurves vertonen dan karakteristieke pauzes, omdat energie wordt geabsorbeerd of vrijgegeven voor de transformatie zelf, en niet voor de temperatuurverandering. In het geval van legeringen is de situatie niet meer zo ‘puntvormig’. Het komt vaak voor dat een legering bij de ene temperatuur begint te stollen, maar bij een andere temperatuur eindigt, en dat tijdens het proces fasen met verschillende samenstellingen naast elkaar bestaan.
Daarom worden in de materiaalkunde fase-evenwichtsdiagrammen, ook wel fasendiagrammen genoemd, gebruikt. Een dergelijk diagram kan worden beschouwd als een kaart: het laat zien welke fasen stabiel zijn, afhankelijk van de temperatuur en samenstelling, en in welke volgorde de transformaties plaatsvinden tijdens het verwarmen en afkoelen. Hierdoor is het mogelijk om zowel het verloop van de kristallisatie en de daaropvolgende transformaties in de vaste toestand te voorspellen, als de structuur en eigenschappen van de afgewerkte legering.
Belangrijkste begrippen: systeem, fase en componenten
Om evenwichtsdiagrammen correct te kunnen lezen, moet u de taal begrijpen die ze ‘spreken’. In thermodynamische termen is een systeem een afzonderlijk fragment van de werkelijkheid dat onder bepaalde omstandigheden wordt geanalyseerd, bijvoorbeeld een monster van een legering dat we koelen. Een fase betekent een homogeen deel van een systeem met identieke eigenschappen en een constante chemische samenstelling, gescheiden van andere fasen door een fasegrens. Een fase kan een vloeistof, een vaste oplossing of een specifieke intermetallische fase zijn, indien deze wordt gevormd.
De bestanddelen, d.w.z. de stoffen (meestal elementen) waaruit de legering bestaat en waaruit fasen kunnen worden gevormd, zijn ook belangrijk. In de context van binaire diagrammen verwijzen we meestal naar een systeem dat bestaat uit twee bestanddelen waarvan de verhoudingen in de legering variëren. In de praktijk betekent dit dat het diagram niet één enkel ‘materiaal’ beschrijft, maar eerder een hele familie van legeringen met verschillende samenstellingen, en elke verandering in samenstelling brengt ons naar een andere plaats op de fasekaart.
Gibbs-faseregel
Een van de redenen waarom het gedrag van legeringen verschilt van dat van zuivere metalen, is het aantal variabelen dat het systeem ‘regelt’. De faseregel van Gibbs organiseert de relatie tussen het aantal componenten, het aantal fasen en het aantal vrijheidsgraden. In de metallurgische praktijk wordt vaak uitgegaan van constante druk, omdat het effect ervan op metaalfaseovergangen doorgaans klein is in vergelijking met het effect van temperatuur en samenstelling.
De praktische betekenis hiervan is: als het systeem weinig ‘manoeuvreerruimte’ heeft, moet de overgang plaatsvinden bij één temperatuur (vandaar de karakteristieke stops). Wanneer er echter variabiliteit in de samenstelling is en de mogelijkheid bestaat dat meerdere fasen naast elkaar bestaan, kan het systeem gebieden passeren waar twee fasen gelijktijdig voorkomen en hun samenstelling verandert met de temperatuur. Dan strekken stolling of transformaties in vaste toestand zich uit over een bepaald temperatuurbereik en wordt de structuur in fasen gevormd.
Hoe wordt een binair evenwichtsdiagram gemaakt?
Een typisch binair diagram toont de relatie tussen temperatuur en chemische samenstelling. De horizontale as vertegenwoordigt de samenstelling van de legering (bijvoorbeeld het percentage van een component) en de verticale as vertegenwoordigt de temperatuur. Om een dergelijk diagram op te stellen, wordt een reeks experimenten uitgevoerd voor veel legeringen met verschillende verhoudingen van componenten en worden de temperaturen waarbij de transformaties plaatsvinden geregistreerd – meestal door middel van thermische analysemethoden, gebaseerd op afkoelings- en verwarmingscurves.
De grenzen van de fasegebieden zijn bijzonder belangrijk in de grafiek. Een lijn genaamd liquidus scheidt het volledig vloeibare gebied van het gebied waar de vloeistof samen met de vaste fase voorkomt. De soliduslijn markeert de grens waaronder de legering volledig vast is. Tussen de liquidus en de solidus bevindt zich meestal een menggebied (bijv. vloeibare + vaste fase), wat in de praktijk betekent dat de legering tijdens het afkoelen een fase doorloopt waarin een deel van het materiaal al vast is en een deel vloeibaar blijft.
Het is ook belangrijk hoe de samenstelling van de fasen bij een bepaalde temperatuur wordt afgelezen. Dit gebeurt door een horizontale lijn (isotherm) door de grafiek te trekken: het snijpunt met de liquidus geeft de samenstelling van de vloeistof weer, en het snijpunt met de solidus geeft de samenstelling van de vaste fase weer in evenwicht bij die temperatuur. Dit is de basis voor het afleiden van wat er werkelijk gebeurt in de legering tijdens het afkoelen.
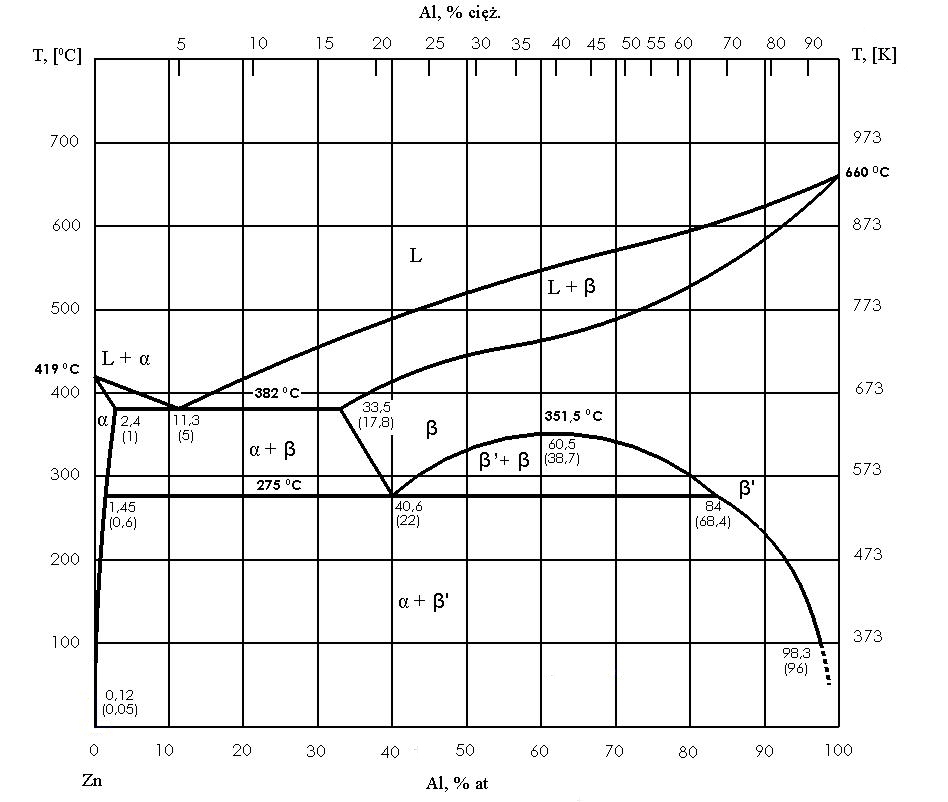
De belangrijkste soorten evenwichtssystemen
Continue vaste oplossing
In sommige systemen mengen de componenten zich vrijelijk met elkaar in zowel vloeibare als vaste toestand. In dit geval is er onder de solidus één fase – een vaste oplossing met een samenstelling die afhankelijk is van de positie op de samenstellingsas. Tijdens het afkoelen begint de legering te stollen bij de liquidus wanneer de eerste kristallen van de vaste oplossing verschijnen, en eindigt bij de solidus wanneer het laatste deel van de vloeistof verdwijnt. Dit is een klassiek voorbeeld van stolling in een temperatuurbereik, zonder een enkele onderbreking.
Het is vermeldenswaard dat in het gebied van ‘vloeibare + vaste oplossing’ de samenstelling van beide fasen verschillend is en verandert met de temperatuur. Door de isotherm te lezen, kunnen we bepalen welk deel van de legering op een bepaald moment al in vaste toestand is en welk deel nog vloeibaar is.
Eutectisch
Een eutectisch systeem is zeer kenmerkend wanneer de componenten zich in een vloeistof mengen, maar slecht of helemaal niet oplossen in een vaste toestand. In dit geval is er een eutectische samenstelling en temperatuur waarbij een homogene vloeistof in twee vaste fasen tegelijk overgaat. Een dergelijke transformatie is isotherm, dus er is een duidelijke pauze op de afkoelingscurve, zoals in het geval van zuiver metaal, maar het mechanisme is anders: in plaats van een enkele vaste fase wordt een fijn mengsel van twee fasen gevormd, meestal met een specifieke, regelmatige morfologie.
Legeringen met een andere samenstelling dan eutectisch vormen een gemengde structuur. Als de legering hypoeutectisch is, worden eerst primaire kristallen van één fase gescheiden en pas daarna stolt de rest van de vloeistof als eutectisch. Als de legering hypereutectisch is, verschijnen eerst primaire kristallen van de tweede fase, gevolgd door het eutecticum. Als gevolg hiervan is de microstructuur afhankelijk van de samenstelling: het eutecticum kan domineren, de primaire kristallen kunnen domineren, of beide componenten kunnen vergelijkbare verhoudingen hebben.
Eutectisch met beperkte oplosbaarheid in vaste toestand
In de praktijk doet zich vaak een tussenliggende situatie voor: de componenten mengen goed in vloeibare toestand, maar in vaste toestand vormen ze slechts in beperkte mate vaste oplossingen. In plaats van ‘zuivere’ fasen worden dan vaste grensoplossingen gevormd, gewoonlijk aangeduid als α en β, en het eutecticum wordt een mengsel van deze twee oplossingen met verzadigde samenstellingen bij de eutectische temperatuur.
Dit is erg belangrijk omdat bij verdere afkoeling de oplosbaarheid in vaste toestand vaak afneemt, waardoor α- en β-oplossingen oververzadigd kunnen raken. Als gevolg hiervan kunnen secundaire scheidingen en verdere ‘rijping’ van de structuur optreden nadat de stolling is voltooid. Het diagram is daarom niet alleen een beschrijving van kristallisatie, maar ook een leidraad voor de veranderingen in de vaste toestand die van invloed zijn op de eigenschappen van het materiaal.
Peritecticum
In peritectische systemen vindt een transformatie plaats waarbij de vloeistof reageert met de bestaande vaste fase om een nieuwe vaste fase te vormen. Dit gebeurt bij een specifieke temperatuur omdat er op het moment van de reactie drie fasen naast elkaar bestaan. Het peritectische mechanisme is van praktisch belang omdat de nieuwe fase vaak groeit op de kristallen van de oorspronkelijke fase, waardoor een laag wordt gevormd die verdere diffusie van de componenten belemmert. Dit kan ervoor zorgen dat het werkelijke verloop van de transformatie afwijkt van het ideale evenwicht, vooral bij snellere afkoeling.
Vanuit technologisch oogpunt kan peritectiek een bron zijn van heterogeniteit en structuren die niet alleen afhankelijk zijn van het evenwichtsdiagram zelf, maar ook van de kinetica, d.w.z. de snelheid van diffusieprocessen. Bij het interpreteren van diagrammen is het daarom belangrijk om te onthouden dat het diagram het evenwicht beschrijft en niet altijd de werkelijke toestand ‘op dat moment’, zonder dat er tijd is om de samenstelling in evenwicht te brengen.
Beperkte oplosbaarheid in vloeistof
Soms is het systeem zelfs in vloeibare toestand niet volledig homogeen. Het kan gebeuren dat de vloeistof binnen een bepaald temperatuurbereik uiteenvalt in twee vloeistoffen met verschillende samenstellingen, wat segregatie en de vorming van gebieden met verschillende eigenschappen bevordert. In een dergelijk systeem is een monotectische transformatie mogelijk, waarbij de ene vloeistof verandert in een andere vloeistof en een vaste fase.
Vanuit het oogpunt van giettechnologie is dit belangrijk omdat de scheiding van vloeistoffen kan leiden tot ongewenste heterogeniteit van de legering. In de praktijk wordt dit vaak tegengegaan door een passende procescontrole, waaronder de keuze van de afkoelsnelheid of de methode voor het mengen van het vloeibare metaal, om de tijd waarin segregatie zich kan ontwikkelen te beperken.
Chemische verbindingen en intermetallische fasen
In veel systemen worden chemische verbindingen en intermetallische fasen gevormd. Als een verbinding een constante stoichiometrische samenstelling heeft, verschijnt deze in het diagram als een karakteristieke positie die overeenkomt met deze verhouding van componenten. Een dergelijke verbinding kan op een ‘zuiver metaalachtige’ manier smelten wanneer deze wordt omgezet in een vloeistof met dezelfde samenstelling, of deze kan worden gevormd en verdwijnen in peritectische transformaties wanneer het proces verloopt door reactie met de vloeistof.
Intermetallische fasen zijn vaak hard en broos, en hun aanwezigheid kan de eigenschappen van de legering aanzienlijk veranderen. Om deze reden zijn fasediagrammen bijzonder belangrijk bij het ontwerpen van legeringen, omdat ze ons in staat stellen te voorspellen of er binnen een bepaald bereik van samenstelling en temperatuur een fase zal verschijnen die de plasticiteit zal aantasten of, omgekeerd, de legering zal versterken door fijne neerslagen.
Vaste-stof transformaties: eutectoïde en peritectoïde
Evenwichtsdiagrammen eindigen niet bij stolling. In veel legeringen zijn transformaties die plaatsvinden na de overgang naar de vaste toestand belangrijk, vooral wanneer de oplosbaarheid in vaste oplossingen verandert met de temperatuur of wanneer een van de componenten polymorfisme vertoont. Van bijzonder belang is de eutectoïde transformatie, die gelijkwaardig is aan eutectica, maar volledig in de vaste toestand plaatsvindt: één vaste oplossing valt bij een constante temperatuur uiteen in twee vaste fasen. Deze transformatie leidt vaak tot een fijne, regelmatige structuur en kan de mechanische eigenschappen aanzienlijk veranderen.
Er is ook een peritectoïde transformatie, analoog aan peritectica, maar zonder tussenkomst van vloeistof: twee vaste fasen reageren om een derde vaste fase te vormen. In de praktijk kunnen transformaties in vaste toestand cruciaal zijn, omdat ze de hardheid, slagvastheid of kruipweerstand kunnen bepalen, zelfs als het stollingsproces correct is verlopen.
Praktische betekenis
De belangrijkste conclusie uit de analyse van de diagrammen is dat de eigenschappen van legeringen voornamelijk het gevolg zijn van hun structuur, en niet alleen van de elementen die ze bevatten. Enkelfasige legeringen zijn doorgaans homogener en hun eigenschappen veranderen vaak gelijkmatiger met de samenstelling. Bij meerfasige legeringen is de situatie complexer, omdat het gedrag van het materiaal wordt bepaald door het type fasen, hun verhouding, verdeling, korrelgrootte en morfologie (bijvoorbeeld de vorm van eutectica of de aard van precipitaten).
Een fasediagram is dus een hulpmiddel dat helpt om de procesomstandigheden te koppelen aan het resultaat. Als u weet bij welke temperaturen en samenstellingen bepaalde fasen optreden, kunt u bewust de legeringssamenstelling en de koel- en warmtebehandeling somstandigheden selecteren. In de praktijk betekent dit dat het mogelijk is om te voorspellen of de legering de neiging heeft om te segregeren, of er broze intermetallische fasen zullen verschijnen, of precipitaten kunnen worden gebruikt voor versterking, of dat de structuur stabiel zal zijn onder bedrijfsomstandigheden.
Fase-evenwichtssystemen van legeringen – samenvatting
Fase-evenwichtssystemen zijn een hulpmiddel dat het gedrag van legeringen systematisch en voorspelbaar organiseert. Ze kunnen worden gebruikt om te bepalen welke fasen stabiel zullen zijn, wanneer de stolling begint en eindigt, of er eutectische of peritectische verschijnselen zullen optreden en welke transformaties er in de vaste toestand kunnen plaatsvinden. In de praktijk betekent dit dat de microstructuur kan worden gecontroleerd en daarmee ook de mechanische en fysische eigenschappen van het materiaal. Het kunnen lezen van fasediagrammen is daarom een van de belangrijkste vaardigheden in de materiaalkunde en metallurgie, omdat hiermee de theorie van faseovergangen kan worden vertaald naar concrete technische beslissingen.