Inżynieria biomedyczna w kontekście materiałoznawstwa
Spis treści
Inżynieria biomedyczna to dziś rozległy ekosystem wiedzy, w którym nauka o materiałach, mechanika płynów i zjawiska transportowe, techniki pomiarowe oraz inżynieria systemów splatają się z fizjologią i praktyką kliniczną. Drugie wydanie The Biomedical Engineering Handbook pod redakcją J.D. Bronzino syntetyzuje te wątki, pokazując, jak od wyboru materiału i stanu jego powierzchni przez konstrukcję czujników i charakterystykę przepływu masy, aż po projekt narządu sztucznego i jego wytwarzanie precyzyjne. W niniejszym artykule rozwijam tę perspektywę na przykładach z obszaru biomateriałów, sensoryki biomedycznej, inżynierii tkanek i narządów sztucznych, zwracając uwagę na implikacje dla technologii wytwarzania i kontroli jakości.
W inżynierii biomedycznej nie istnieją izolowane decyzje — dobór klasy materiału, topografia i chemia powierzchni, warunki przepływu i wymiany masy, architektura urządzenia oraz jego proces wytwarzania tworzą systemową całość, którą należy projektować pod konkretne wskazanie kliniczne i reżim obciążeń biologicznych
Miejsce materiałoznawstwa w inżynierii biomedycznej
W ujęciu encyklopedycznym biomateriał to tworzywo przeznaczone do bezpośredniego kontaktu z tkanką w urządzeniu medycznym, zaprojektowane tak, by bezpiecznie i skutecznie zastępować strukturę lub funkcję organizmu. Szeroki przegląd klas i zagadnień konstrukcyjnych daje sekcja „Biomaterials”, obejmująca metale, ceramiki, polimery, kompozyty, polimery biodegradowalne i materiały pochodzenia biologicznego, a także problematykę konserwacji i mocowania endoprotez. Już sam układ rozdziałów prowadzi od doboru podstawowych klas tworzyw do zagadnień integracji z tkankami twardymi i miękkimi, co dobrze oddaje systemowy charakter pola.
W metalach (stale Cr–Ni–Mo, stopy Co–Cr, stopy tytanu) klucz stanowi odporność korozyjna i zmęczeniowa oraz możliwość precyzyjnego kształtowania mikrostruktury. Z perspektywy praktycznej książka podkreśla, że historia przetwarzania — wytapianie, odkształcanie plastyczne, obróbka cieplna, czyszczenie, a nawet końcowe mikroobróbki — koreluje z odpornością na korozję szczelinową i naprężeniową oraz z pękaniem zmęczeniowym. Co istotne dla produkcji precyzyjnej, rozdział o metalach obejmuje także zagadnienia „Manufacturing of Implants”, co potwierdza nierozerwalność projektowania materiałowego i technologii wytwarzania w medycynie.
Ceramiki (alumina, cyrkonia, węgle, szkło-ceramiki, układy fosforanów wapnia) oferują twardość, odporność chemiczną i — w przypadku bioaktywnych szkło-ceramik — zdolność tworzenia chemicznie pośredniczonej więzi z tkanką. Jednocześnie monografia przypomina o kruchości i mechanizmach deterioracji ceramik, a także opisuje techniki wytwarzania bioceramicznego pod kątem zastępowania tkanki twardej i integracji tkankowej; to właśnie tutaj projekt geometrii, porowatości i jakości powierzchni spotyka się z restrykcyjną kontrolą wad krytycznych dla wytrzymałości na pękanie.
Polimery stanowią materiałowy szwajcarski scyzoryk biomedycyny: od PVC i PE przez PMMA i PU po poliestrowe układy biodegradowalne, z bogatym arsenałem modyfikacji powierzchni dla poprawy biozgodności. Szczególne znaczenie ma fakt, że ta klasa umożliwia sterowanie właściwościami przez masę i dystrybucję mas cząsteczkowych, strukturę chemiczną oraz cross-linking, a także pozwala zespolić funkcję mechaniczno-barierową z bioaktywnymi motywami chemicznymi. Omawiana jest także sterylizacja i jej wpływ na własności oraz metody chemogradientowego kształtowania interfejsu białko–powierzchnia, co bezpośrednio przekłada się na hemokompatybilność i adhezję komórkową.
W kompozytach, dzięki strukturze (cząstki, włókna, porowatość), można połączyć sprzeczne wymagania: modulować anizotropię, dopasować moduł do kości, poprawić tłumienie drgań i uzyskać stopniowane przejścia własności. Monografia porządkuje te zagadnienia, omawiając granice własności, porowatość i biokompatybilność. Z perspektywy produkcji, kontrola rozkładu faz i defektów na styku osnowa–wzmocnienie staje się równie ważna jak sam materiał.
Wybór i kwalifikacja biomateriału nie mogą abstrahować od technologii jego przetworzenia i od zamierzonego sposobu obciążenia ten sam materiał przy innej mikrostrukturze, topografii i czystości powierzchni będzie wykazywać inny profil korozji, zużycia, adsorpcji białek i integracji tkankowej. W projektowaniu trzeba więc równocześnie sterować mikrostrukturą objętości i interfejsem biofizykochemicznym
Sensoryka biomedyczna i interfejsy materiał–biologia
Czujniki biomedyczne stanowią interfejs pomiędzy układem biologicznym a systemem elektronicznym, konwertując wielkości geometryczne, mechaniczne, termiczne, hydrauliczne lub chemiczne do sygnałów, najczęściej elektrycznych. Kompendium podkreśla dwoistą klasyfikację: czujniki fizyczne, mierzące m.in. przemieszczenia mięśni, ciśnienie krwi czy przepływ płynów, oraz czujniki chemiczne, identyfikujące związki, stężenia i aktywności — od elektrochemicznych, przez fotometryczne, po złożone systemy analityczne. Sensory optyczne wyróżniono jako niezwykle wszechstronne narzędzie zarówno detekcyjne, jak i transmisyjne dzięki światłowodom.
Szczególne miejsce zajmują elektrody biopotencjałowe, niezbędne w diagnostyce i terapii. Ich działanie zależy nie tylko od układu elektronicznego i geometrii, ale przede wszystkim od tego, jak wchodzą w kontakt z biologicznym otoczeniem. Różne aplikacje — od powierzchniowych Ag/AgCl po igły EMG oraz cienkowarstwowe mikroelektrody do rejestracji wewnątrzsercowej i w ośrodkowym układzie nerwowym — wymagają różnej konfiguracji materiałów, powłok i konstrukcji mechanicznej, a także odmiennych procedur kwalifikacji. Problem odrzutu i powstawania reakcji na ciało obce obniża stabilność sygnału i trwałość interfejsu, więc nie jest to tylko kwestia elektroniki, lecz również chemii i topografii powierzchni oraz czystości procesu.
Książka porządkuje też sposoby przyłożenia sensora do pacjenta — od metod niekontaktowych, przez kontaktowe na skórze, przez minimalnie inwazyjne sensowy wewnątrzustrojowe, aż po implantowalne. Każdy z tych sposobów wyznacza inne wymagania dotyczące biozgodności, stabilności sygnału i strategii dezynfekcji/sterylizacji, co ma bezpośrednie konsekwencje dla doboru materiału i technologii wytwarzania.
Projekt sensora biomedycznego to projekt interfejsu: parametry elektryczne i mechaniczne są równie krytyczne jak dobór materiału kontaktowego, jego powłok, preparatyki powierzchni i sposobu mocowania, które determinują bioreakcję i dryf sygnału w czasie.
Zjawiska transportowe i wymuszenia mechaniczne
Inżynieria tkankowa oraz projektowanie narządów sztucznych wyrastają z rozumienia, że transport masy, energii i pędu w skali od mikronów do centymetrów steruje funkcją tkanek i wyrobów. Redaktorzy sekcji „Tissue Engineering” podkreślają dwa motywy inżynierskie: własności i rozwój materiałów na dwóch skalach długości (molekularnej i komórkowej) oraz analiza procesów szybkościowych. Na poziomie powierzchni chodzi o inżynierię biomolekularną (immobilizacja ligandów adhezyjnych, kontrola gęstości motywów), a także o zjawiska adsorpcji białek, które kształtują dalszą odpowiedź komórkową. Na poziomie mezoskali kluczowe są rusztowania i szablony regeneracji o precyzyjnie ustalonym rozmiarze porów, przepuszczalności i degradacji.
Dalej wchodzą w grę naprężenia styczne od przepływu oraz tempo dyfuzji i konwekcji składników odżywczych, tlenu i metabolitów. Rozdziały poświęcone wpływowi naprężeń ścinających na komórki oraz roli transportu masy w funkcji tkanki pokazują, że środowisko mechaniczne i gradienty stężeń przekładają się na morfologię, reorganizację cytoszkieletu, transdukcję sygnałów, wydzielanie metabolitów i regulację genów komórek śródbłonka — a więc na rozwój, stabilność i funkcję neotkanek. Wniosek jest prosty: bez kontroli przepływu i wymiany masy nawet najlepiej dobrany materiał nie zadziała w przewidywalny sposób.
W inżynierii tkanek i narządów sztucznych parametry przepływu i dyfuzji są tak samo materiałem projektowym jak polimer czy ceramika. Bioreaktory, struktura porów i właściwości przepływowe wyrobu muszą być strojonymi zmiennymi konstrukcji.
Inżynieria tkanek
Inżynieria tkanek definiuje się jako zastosowanie zasad naukowych do projektowania, konstruowania, modyfikowania, wzrostu i utrzymania żywych tkanek. W ujęciu Bronzino i współautorów, aby to było możliwe, należy jednocześnie dobrać linię komórkową i źródło komórek, zaprojektować interfejs macierz–komórka i kontrolę organizacji tkanki, a także zapewnić zasilanie metaboliczne. Tu materiały spotykają się z biologią: immobilizowane ligandy adhezyjne, kontrola adsorpcji białek i mikroarchitektura rusztowań decydują o adhezji, proliferacji i różnicowaniu.
W praktyce rdzeniem są rusztowania o rozmiarach cech 10–100 µm, które determinują transport, zasiedlenie komórkowe i kierunek wzrostu tkanki. Z tej perspektywy kluczowa jest klasa polimerów biodegradowalnych: rozdział poświęcony biodegradowalnym polimerom opisuje zarówno glikolido- i laktydo-pochodne poliestry alifatyczne, jak i alternatywne rodziny, oraz modelowanie ich degradacji. Autor akcentuje dwie przewagi: zanik przewlekłej reakcji ciała obcego w miarę resorpcji oraz zdolność do służenia jako tymczasowe szkielety regeneracji tkankowej.
Materiały kolagenowe, jako układy pochodzenia tkankowego, oferują z kolei biologicznie znaną architekturę macierzy pozakomórkowej. Sekcja o kolagenie opisuje zarówno strukturę chemiczną i właściwości fizykochemiczne, jak i technologie wytwarzania membran, pian porowatych, żeli i kompozytów, a także kryteria projektowania resorbowalnych implantów kolagenowych pod względem porowatości, gęstości pozornej, hydrofilowości, przepuszczalności i stabilności in vivo. Te parametry są jednocześnie parametrami procesu wytwarzania: szybkość suszenia, warunki liofilizacji, środki sieciujące i czystość odczynników bezpośrednio przekładają się na wynik biologiczny.
Na przecięciu materiału i mechaniki przepływu pojawiają się urządzenia i bioreaktory: systemy włókien kapilarnych i mikro nośników umożliwiają podtrzymanie metabolizmu przy gęstościach komórkowych potrzebnych do odbudowy tkanek, o ile zapewni się kontrolę naprężeń ścinających i gradientów stężeń. Ta sama logika obowiązuje w skali klinicznej, gdy rusztowanie zasiedlane jest in situ: perfuzja, dyfuzja i mechaniczne wymuszenia gospodarza piszą dalszy los implantu.
Narządy sztuczne i medycyna substytucyjna
Sekcja „Prostheses and Artificial Organs” pokazuje, że substytucja funkcji narządów może być pomostowa (np. krążenie pozaustrojowe), przerywana i powtarzalna (hemodializa, CAPD) albo długotrwała z implantacją. Równocześnie autorzy uczciwie wskazują granice: jak każda maszyna, narząd sztuczny ma ograniczoną żywotność serwisową, wynikającą z tarcia, zużycia i starzenia materiałów w ciepłym, wilgotnym i korozyjnym środowisku ciała. Bilans korzyści zależy więc od zestawienia oczekiwanej żywotności urządzenia, sposobu jego serwisowania/wymiany i prognozy co do stanu pacjenta. Ten realizm inżynierski współistnieje z faktem demograficznym: miliony pacjentów żyją dzięki stymulatorom, zastawkom, dializom czy układom drenażu.
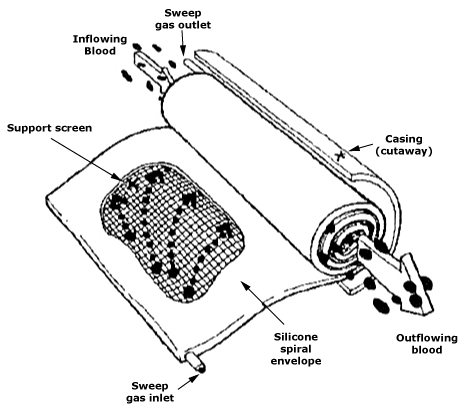
Przykład sztucznej nerki jest szczególnie dydaktyczny: to urządzenie ucieleśniające transport masy. W dializie to membrany, współczynniki przenikalności, klirensy i warunki przepływu, a także farmakokinetyka i adekwatność zabiegu determinują efekt kliniczny. Każda z tych wielkości powiązana jest z materiałoznawstwem (chemia i architektura membran), mechaniką płynów (przepływ laminarny/turbulentny, zjawiska przyścienne) i niezawodnością eksploatacyjną. Stąd także intensywny rozwój hemodiafiltracji, modyfikacji powierzchni i nowych polimerów membranowych.
W układzie sercowo-naczyniowym widać starcie wymagań hemokompatybilności z trwałością mechaniczną. Projekt zastawek obejmuje zarówno ocenę hemodynamiczną (spadki ciśnień, straty energii, przepływy wsteczne i obszary zastoju), jak i zagadnienia depozycji skrzeplin i trwałości cyklicznej. W przeszczepach naczyniowych walczy się z zakrzepicą i przerostem neointimy, wprowadzając modyfikacje materiałów i geometrii, które wpływają na rozkład naprężeń ścinających i charakter przepływu. Każda zmiana materiału lub topografii powierzchni to nie kosmetyka, lecz interwencja w biologię trombogenezy i gojenia.
Z kolei biohybrydowe narządy — urządzenia z udziałem elementów żywych — łączą technologie transplantacyjne z konstrukcjami syntetycznymi, obiecując funkcje bliższe naturze przy jednoczesnym narzucie wymagań materiałowych i procesowych. To pole, w którym inżynieria tkanek i aparatura do wymiany masy przeciągają linę w jedną stronę: ku coraz bardziej funkcjonalnym i odpornym interfejsom.
Produkcja precyzyjna i kontrola jakości
To, jak i z czego wyrób jest wytwarzany, determinuje jego stan końcowy. W metalach procesy obróbki — walcowanie, kucie, obróbka cieplna, skrawanie, a także metody czyszczenia i pasywacji — ustalają teksturę, wielkość ziarna, naprężenia resztkowe i skład warstwy wierzchniej, które sterują zmęczeniem, korozją i adhezją komórkową. Dla stali, stopów Co–Cr i Ti monografia omawia nie tylko własności, ale i specyfikę wytwarzania implantów, tworząc pomost między inżynierią materiałową a technologią. To przejście z karty katalogowej do karty procesu, które w medycynie jest absolutnie krytyczne.
W ceramice wybór metody syntezy i spiekania, kontrola frakcji faz i defektów oraz obróbka powierzchni przekładają się na odporność na pękanie i na zdolności bioaktywne. W szczególności w bioceramikach szkło-ceramicznych i hydroksyapatytach precyzyjna kontrola składu, krystaliczności i porowatości wiąże się wprost z integracją tkankową i wytrzymałością na ściskanie. To dziedziny, w których metrologia porowatości, topografii i wad staje się częścią klinicznego bezpieczeństwa.
W polimerach proces określa materiał: historia termiczno-mechaniczna, środowisko wygrzewania, dobór sterylizacji i dodatków stabilizujących determinują degradację i starzenie. Monografia zwraca uwagę na dwie sfery: modyfikacje powierzchni (fizyczne i chemiczne) jako narzędzie do poprawy biozgodności i adhezji białek/komórek oraz tworzenie powierzchni chemogradientowych, które pozwalają badać i kształtować zachowanie biologiczne. Z produkcyjnego punktu widzenia oznacza to, że preparatyka powierzchni — plazma, silanizacja, warstwy szczepione — powinna być zwalidowaną, powtarzalną operacją procesu, a nie sztuką.
W inżynierii tkanek i narządach biohybrydowych technologia wytwarzania obejmuje konstrukcję mikroarchitektur rusztowań, metody ich sterylizacji bez utraty funkcji biologicznych, a także kontrolę parametrów bioreaktorów i procedur zasiedlania komórkowego. Projektując immunoprotekcyjne kapsułki lub otwarte architektury, trzeba jednocześnie kontrolować dyfuzję, przenikalność i mechanikę ścianek.
Klasy materioałów
Przenosząc powyższe zasady na wskazania kliniczne, widać, że w ortopedii wybór pary trącej i strategii mocowania endoprotezy wiąże się z kompromisem między zużyciem, stabilnością mechaniczno-zmęczeniową i biologiczną integracją z kością. To dlatego w literaturze pojawia się intensywny rozwój powłok porowatych, bioaktywnych oraz modyfikacji powierzchni polimerów o ultra wysokiej masie cząsteczkowej. W stomatologii analogiczną logikę stosuje się do implantów i uzupełnień, gdzie ceramiki bioobojętne i bioaktywne oraz tytan/cyrkonia łączą się z potrzebą mikro- i nano-tekstur, które promują osteointegrację i szczelność biologiczną przejścia śluzówkowego. W układzie sercowo-naczyniowym zaś projekt zastawek i graftów jest wprost pochodną hemodynamiki oraz prokoagulacyjnych konsekwencji lokalnej geometrii i szorstkości.
W obszarze nerek urządzenia membranowe pokazują, jak teoria klirensu, permeabilności i całkowitego transportu przekłada się na realny schemat terapii, farmakokinetykę leków oraz ocenę adekwatności dializy — i jak drobne różnice w membranach, przepływach i układzie hydrauliki skutkują różnicami klinicznymi. Translacja do kliniki wymaga mapowania wymagań fizjologicznych na parametry materiałowe, geometryczne, transportowe i produkcyjne; nie ma najlepszego materiału poza kontekstem konkretnego zastosowania i sposobu obciążenia.
Redaktorzy monografii wskazują kierunek ewolucji: urządzenia integrujące żywe komponenty z konstrukcjami syntetycznymi; biohybrydowe narządy i protezy informacyjne, które dostarczają organizmowi sygnałów zastępczych lub modulowanych tak, by skorygować stan chorobowy. To nie tylko kwestia algorytmów sterowania, ale i materiałów oraz interfejsów powierzchniowych, które muszą funkcjonować przewidywalnie przez lata. Rozwój w stronę urządzeń miękkiej robotyki i sensorów o wysokiej swoistości biologicznej (enzym–substrat, antygen–przeciwciało, ligand–receptor) nakłada na projektantów obowiązek mistrzowskiego opanowania technologii mikro- i nano-wytwarzania oraz stabilizacji warstw aktywnych.
Inżynieria biomedyczna w kontekście materiałoznawstwa – podsumowanie
Drugie wydanie The Biomedical Engineering Handbook rozkłada przed czytelnikiem mapę drogową inżynierii biomedycznej: od klas biomateriałów, przez sensory i pomiary, po inżynierię tkanek i narządy sztuczne. W całym obrębie tej mapy powracają trzy motywy. Pierwszy to systemowość: materiał, powierzchnia, transport, mechanika płynów, elektronika i proces wytwarzania są nierozerwalne i wspólnie determinują bezpieczeństwo oraz skuteczność. Drugi to skalowalność: od molekuł i ligandów adhezyjnych, przez architektury 10–100 µm, po całe urządzenia, parametry na jednej skali muszą być zgodne z wymaganiami na pozostałych. Trzeci to produkowalność: sterylizacja, utrzymanie czystości, kontrola porowatości i chropowatości, pasywacja i modyfikacje powierzchni to nie dodatki, lecz element projektu.
W rezultacie projektant biomedyczny działa jak dyrygent — koordynując materiały, przepływy, sygnały i procesy tak, by łącznie uruchomić pożądaną odpowiedź biologiczną i osiągnąć stabilność eksploatacyjną. Ta perspektywa, konsekwentnie rozwijana w monografii, pozostaje aktualnym fundamentem dla praktyków w biomedycynie, stomatologii i produkcji precyzyjnej.
Bibliografia
Bronzino, J.D. (red.). The Biomedical Engineering Handbook. Second Edition. CRC Press, Boca Raton, 2000.




