Le génie biomédical dans le contexte de la science des matériaux
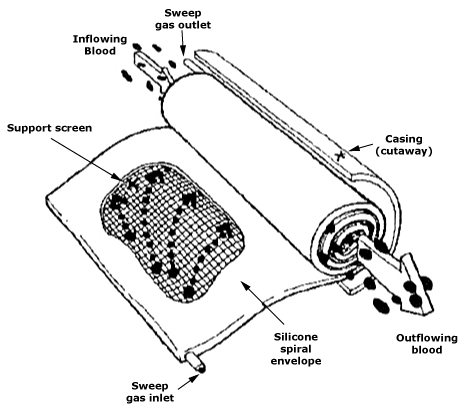
Table des matières
Le génie biomédical est désormais un vaste écosystème de connaissances, dans lequel la science des matériaux, la mécanique des fluides, les phénomènes de transport, les techniques de mesure et l’ingénierie des systèmes croisent la physiologie et la pratique clinique. La seconde édition du The Biomedical Engineering Handbook, éditée en 2000 par J.D. Bronzino, synthétise ces thèmes et montre comment le choix du matériau et de son état de surface, à travers la conception des capteurs et les caractéristiques de débit massique, influence la conception des organes artificiels et leur fabrication de précision.
Cet article va vous aider à comprendre une telle perspective grâce à des exemples tirés des domaines des biomatériaux, de la détection biomédicale, de l’ingénierie tissulaire et des organes artificiels, tout en soulignant les implications étroites avec la technologie de fabrication et le contrôle qualité.
En génie biomédical, il n’y a jamais de décisions isolées, car le choix de la classe de matériaux, la topographie et la chimie de la surface, les conditions d’écoulement et de transfert de masse, l’architecture des dispositifs et le processus de fabrication forment un tout systémique qui doit être strictement conçu pour une indication clinique et un régime de charge biologique spécifiques.
La place de la science des matériaux dans le génie biomédical
D’un point de vue encyclopédique, un biomatériau est un élément destiné à entrer en contact direct avec les tissus dans un dispositif médical, conçu pour remplacer de manière sûre et efficace la structure ou la fonction du corps. Pour ces biomatériaux, nous offrons un aperçu général de leurs classes et des questions de conception. Ceci regroupe les métaux, les céramiques, les polymères, les composites, les polymères biodégradables et les matériaux d’origine biologique, ainsi que ce qui est lié à l’entretien et à la fixation des endoprothèses. La structure générale, passant de la sélection des classes de matériaux de base, aux questions d’intégration avec les tissus durs et mous, reflète bien la nature systémique de ce domaine.
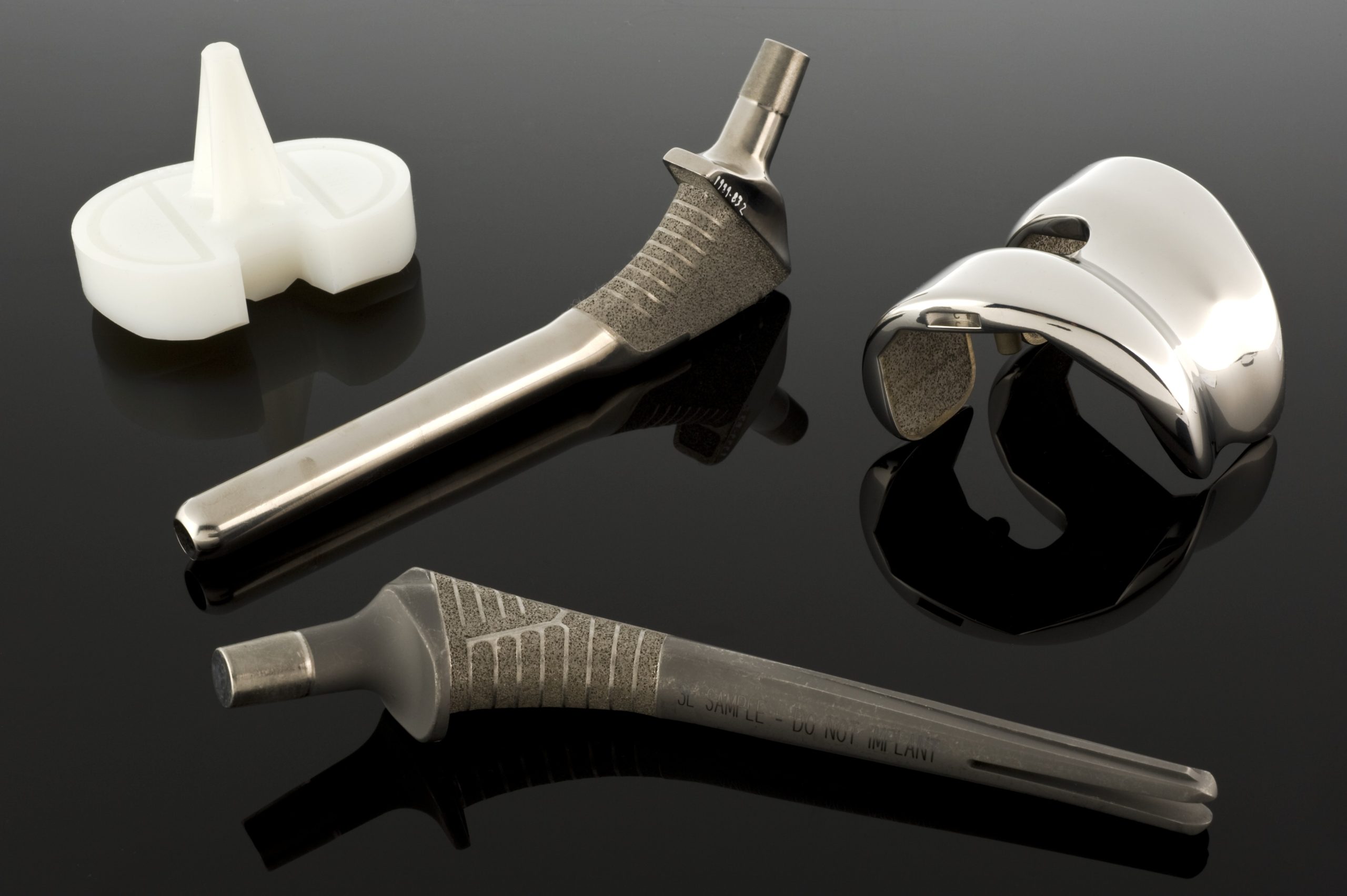
Dans le domaine particulier des métaux, aciers Cr-Ni-Mo, alliages Co-Cr, alliages de titane, la résistance à la corrosion et à la fatigue, ainsi que la capacité à façonner précisément la microstructure, sont primordiales. D’un point de vue pratique, nous devons souligner que l’historique du traitement, par fusion, déformation plastique, traitement thermique, nettoyage et même micro-usinage final, est corrélé à la résistance à la corrosion par crevasses et sous contrainte, ainsi qu’à la fissuration par fatigue. Il est important de noter que, pour la fabrication de précision, le travail sur les métaux couvre également la « fabrication d’implants », confirmant ainsi le caractère indissociable, en médecine, de la conception des matériaux et de la technologie de fabrication.
Les céramiques, alumine, zircone, carbones, vitrocéramiques et autres systèmes à base de phosphate de calcium, offrent tous une dureté, une résistance chimique et, dans le cas des vitrocéramiques bioactives, la capacité de former des liaisons chimiques avec les tissus. Dans le même temps, nous devons nous rappeler la fragilité et les mécanismes de détérioration des céramiques. Les techniques de fabrication des biocéramiques en termes de remplacement des tissus durs et d’intégration tissulaire sont également parfaitement définies. C’est là que la conception de la géométrie, de la porosité et de la qualité de la surface rencontre le contrôle strict des défauts critiques pour la résistance à la fracture.
Il est dit que les polymères sont le « couteau suisse » de la biomédecine, allant du PVC et du PE au PMMA et au PU, en passant par les systèmes en polyester biodégradable, qui possèdent tous un riche arsenal de modifications de surface, ce qui permet d’améliorer la biocompatibilité. Il est particulièrement important de noter que cette classe permet de contrôler les propriétés grâce au poids moléculaire et à la distribution, à la structure chimique et à la réticulation, ainsi qu’à la combinaison d’une fonction de barrière mécanique avec des motifs chimiques bioactifs. La stérilisation et son impact sur les propriétés et les méthodes de modelage du gradient chimique de l’interface protéine-surface doivent être également étudiés et mis au point, car tout ceci se traduit directement par l’hémocompatibilité et l’adhésion cellulaire.
Dans les composites, grâce à leur structure, notamment particules, fibres et porosité, il est désormais possible de combiner des exigences contradictoires, ainsi arriver à moduler l’anisotropie, à adapter le module à l’os, à améliorer l’amortissement des vibrations et à bénéficier, dans les propriétés, de transitions progressives. Il est nécessaire de gérer toutes ces questions, en abordant les limites des propriétés, la porosité et la biocompatibilité. Du point de vue de la production, le contrôle de la distribution des phases et des défauts à l’interface matrice-renfort devient aussi important que le matériau lui-même !
La sélection et la qualification d’un biomatériau ne peuvent donc être dissociées de la technologie utilisée pour le traiter et de la méthode de chargement prévue. Un même matériau présentant une microstructure, une topographie et une propreté de surface différentes, va présenter un profil différent en termes de corrosion, d’usure, d’adsorption des protéines et d’intégration tissulaire. Par conséquent, dans le processus de conception, il est nécessaire de contrôler simultanément la microstructure volumique et l’interface biophysico-chimique.
Capteurs biomédicaux et interfaces matériau-biologie
Les capteurs biomédicaux servent d’interface entre le système biologique et le système électronique, convertissant les données géométriques, mécaniques, thermiques, hydrauliques ou chimiques en signaux électriques. Nous pouvons ici mettre en évidence une double classification, à savoir les capteurs physiques, qui mesurent, entre autres, le déplacement musculaire, la pression sanguine et le débit de fluide. D’autre part, les capteurs chimiques identifient les composés, les concentrations et les activités, depuis les systèmes électrochimiques et photométriques jusqu’aux systèmes analytiques complexes. Les capteurs optiques peuvent être présentés comme un outil très polyvalent pour la détection et la transmission, grâce à la fibre optique.
Les électrodes biopotentielles, essentielles dans le domaine du diagnostic et de la thérapie, occupent ici une place toute particulière. Leur fonctionnement dépend du système électronique lui-même et de la géométrie, mais surtout de leur interaction avec l’environnement biologique. Différentes applications, allant de l’Ag/AgCl de surface, ou des aiguilles EMG, ou encore des microélectrodes à couche mince pour l’enregistrement intracardiaque et du système nerveux central, nécessitent différentes configurations de matériaux, de revêtements et de conception mécanique, ainsi que différentes procédures de qualification. Le problème du rejet et des réactions aux corps étrangers réduisant la stabilité du signal et la durabilité de l’interface, il ne s’agit donc pas d’une question d’électronique, du moins pas uniquement, mais aussi de chimie, de topographie de surface et de propreté des processus.
Il est à noter ici que l’ouvrage de référence organise également les méthodes d’application du capteur au patient, allant des méthodes sans contact, incluant aussi le contact avec la peau, sans oublier les capteurs intra-corporels mini-invasifs et les capteurs implantables. Chacune de ces méthodes a des exigences différentes, en matière de biocompatibilité, de stabilité du signal et de stratégies de désinfection et de stérilisation ! Tout ceci a des conséquences directes sur le choix des matériaux en eux-mêmes, et surtout celui des technologies de fabrication.
La conception d’un capteur biomédical s’apparente à la conception d’une interface, dans laquelle les paramètres électriques et mécaniques sont donc aussi importants que le choix du matériau de contact, ses revêtements, la préparation de la surface et la méthode de montage, qui déterminent collectivement la bioréaction et, au fil du temps, la dérive du signal.
Phénomènes de transport et contraintes mécaniques
L’ingénierie tissulaire, et la conception d’organes artificiels, découlent de la compréhension que le transport de masse, d’énergie et d’impulsion, à une échelle allant du micron au centimètre, contrôle le fonctionnement des tissus et des dispositifs. Toute cette « Ingénierie tissulaire » se scinde en deux thèmes principaux d’ingénierie, à savoir…
Au niveau de la surface, cela implique l’ingénierie biomoléculaire, par exemple immobilisation de ligands adhésifs, contrôle de la densité des motifs, ainsi que les phénomènes d’adsorption des protéines qui, elles, façonnent la réponse cellulaire ultérieure. Au niveau méso, les échafaudages et les modèles de régénération ayant des tailles de pores, des perméabilités et des dégradations, doivent donc être très précisément définies.
En outre, les contraintes tangentielles dues à l’écoulement, ainsi que les vitesses de diffusion et de convection des nutriments, de l’oxygène et des métabolites, sont également impliquées. Les études consacrées à l’influence des contraintes de cisaillement sur les cellules et au rôle du transport de masse dans la fonction tissulaire montrent que l’environnement mécanique et les gradients de concentration se traduisent par la morphologie, la réorganisation du cytosquelette, la transduction des signaux, la sécrétion de métabolites et la régulation génétique dans les cellules endothéliales, et donc sur le développement, la stabilité et la fonction des néotissus. La conclusion en est terriblement simple… sans contrôle de l’écoulement et de l’échange de masse, même le matériau le mieux choisi ne fonctionnera pas de manière prévisible !
Dans l’ingénierie des tissus et des organes artificiels, les paramètres d’écoulement et de diffusion sont tous autant des matériaux de conception que les polymères ou les céramiques. Les bioréacteurs, la structure des pores et les propriétés d’écoulement du produit doivent être ajustés en tant que variables de telles conceptions.
Ingénierie tissulaire
L’ingénierie tissulaire est définie comme étant l’application de principes scientifiques à la conception, la construction, la modification, la croissance et le maintien de tissus vivants. Selon Bronzino et al., pour que cela soit possible, il faut donc sélectionner une lignée cellulaire et une source cellulaire, concevoir une interface matrice-cellule et un contrôle de l’organisation tissulaire, tout en assurant l’approvisionnement métabolique. C’est là que les matériaux rencontrent la biologie… En effet, les ligands adhésifs immobilisés, le contrôle de l’adsorption des protéines et la microarchitecture des échafaudages déterminent l’adhésion, la prolifération et la différenciation.
Dans la pratique, le noyau est constitué d’échafaudages dont la taille varie entre 10 et 100 µm, ce qui détermine le transport, la colonisation cellulaire et la direction de croissance des tissus. De ce point de vue, la classe des polymères biodégradables est indispensable, les distribuant entre polyesters aliphatiques dérivés du glycolide et du lactide, et entre les familles alternatives, ainsi que la modélisation de leur dégradation. Deux avantages méritent ici d’être soulignés. D’une part, la disparition de la réaction chronique au corps étranger à mesure que la résorption progresse et d’autre part, la capacité à servir de structures temporaires pour la régénération tissulaire.
Les matériaux à base de collagène, en tant que systèmes d’origine tissulaire, offrent une architecture de matrice extracellulaire biologiquement familière. Le collagène est décrit à la fois en structure chimique et en termes de propriétés physicochimiques, ainsi que les technologies de production de membranes, de mousses poreuses, de gels et de composites. En outre, sont abordés les critères de conception des implants en collagène résorbables, notamment la porosité, la densité apparente, l’hydrophilie, la perméabilité et la stabilité in vivo. Ces paramètres, qui sont également des paramètres du processus de fabrication, notamment la vitesse de séchage, les conditions de lyophilisation, les agents de réticulation et la pureté des réactifs, se traduisent directement en résultats biologiques.
À l’intersection de la mécanique des matériaux et de la mécanique des fluides, apparaissent des dispositifs et des bioréacteurs. Les systèmes à fibres capillaires et à microporteurs permettent de maintenir le métabolisme à la densité cellulaire requise dans le cadre de la reconstruction tissulaire, à condition que les contraintes de cisaillement et les gradients de concentration soient contrôlés. La même logique s’applique à l’échelle clinique, lorsque le support est colonisé in situ, ainsi la perfusion, la diffusion et les contraintes mécaniques de l’hôte déterminent le sort de l’implant.
Organes artificiels et médecine de substitution
Abordant la section « Prothèses et organes artificiels » nous apprenons que la substitution de la fonction d’un organe peut être temporaire. Par exemple, circulation extracorporelle, ou bien intermittente et répétable, en hémodialyse, en CAPD, ou à long terme, dans le cas d’une implantation. Dans le même temps, il est nécessaire de souligner ici, honnêtement, qu’il existe des limites. Comme toute machine, un organe artificiel a une durée de vie limitée, en raison des frottements, de l’usure et du vieillissement des matériaux dans l’environnement chaud, humide et corrosif du corps. L’équilibre des avantages dépend donc de la combinaison de la durée de vie prévue du dispositif, de la méthode d’entretien et/ou de remplacement et du pronostic de l’état du patient. Ce réalisme technique coexiste avec une réalité démographique, puisque des millions de patients sont en vie grâce à des stimulateurs cardiaques, des valves, des systèmes de dialyse ou de drainage.
L’exemple du rein artificiel est particulièrement instructif. Il s’agit d’un dispositif qui incarne le transport de masse. En dialyse, ce sont les membranes, les coefficients de perméabilité, les clairances et les conditions d’écoulement, ainsi que la pharmacocinétique et l’adéquation de la procédure, qui déterminent l’effet clinique. Chacune de ces variables est liée à la science des matériaux, notamment chimie et architecture des membranes, à la mécanique des fluides, l’écoulement laminaire et/ou turbulent, phénomènes de paroi, et à la fiabilité opérationnelle. C’est pourquoi l’hémodiafiltration, la modification des surfaces et les nouveaux polymères membranaires ont d’ores et déjà fait l’objet d’un développement intensif.
Par ailleurs, dans le système cardiovasculaire, il existe un conflit entre les exigences d’hémocompatibilité et de durabilité mécanique. La conception des valves implique à la fois une évaluation hémodynamique, chutes de pression, pertes d’énergie, reflux et zones de stagnation, et des questions de dépôt de thrombus et de durabilité cyclique. Dans les greffons vasculaires, la thrombose et l’hyperplasie néointimale sont combattues par l’introduction de modifications des matériaux et de la géométrie, qui affectent la distribution des contraintes de cisaillement et les caractéristiques d’écoulement. Tout changement dans la topographie des matériaux ou des surfaces, n’est donc pas purement esthétique, mais constitue plutôt une intervention dans la biologie de la thrombogenèse et de la cicatrisation des plaies.
Les organes biohybrides, quant à eux, sont des dispositifs qui intègrent des éléments vivants et combinent les technologies de transplantation avec des structures synthétiques, promettant des fonctions plus proches de la nature, tout en imposant des exigences en matière de matériaux et de processus. Il s’agit d’un domaine dans lequel l’ingénierie tissulaire et les appareils de remplacement de masse s’orientent dans la même direction, c’est-à-dire vers des interfaces de plus en plus fonctionnelles et résistantes.
Fabrication de précision et contrôle qualité
La manière dont un produit est fabriqué et les matériaux qui le composent déterminent son état final. Dans le domaine des métaux, les méthodes de traitement, telles que le laminage, le forgeage, le traitement thermique, la découpe, ainsi que le nettoyage et la passivation, déterminent la texture, la taille des grains, les contraintes résiduelles et la composition de la couche superficielle qui contrôlent la fatigue, la corrosion et l’adhérence cellulaire. Pour l’acier, des alliages de Co-Cr et de Ti, il est donc nécessaire d’aborder les propriétés, mais aussi les spécificités de la fabrication des implants, comblant ainsi le fossé entre l’ingénierie des matériaux et la technologie. Cette transition de la fiche technique à la fiche de processus est, en médecine, absolument indispensable.
Dans le domaine de la céramique, le choix des méthodes de synthèse et de frittage, le contrôle des fractions de phase et des défauts, ainsi que le traitement de surface se traduisent par la résistance à la fracture et les capacités bioactives. Dans le cas particulier des biocéramiques vitrocéramiques et des hydroxyapatites, le contrôle précis de la composition, de la cristallinité et de la porosité, est directement lié à l’intégration tissulaire et à la résistance à la compression. Ce sont là des domaines où la métrologie de la porosité, de la topographie et des défauts fait partie intégrante de la sécurité clinique.
Dans les polymères, le processus détermine les propriétés du matériau, notamment son historique thermomécanique, son environnement de recuit, le choix de la stérilisation et les additifs stabilisants, qui, tous, influencent la dégradation et le vieillissement. L’ouvrage attire l’attention sur deux domaines particuliers, à savoir les modifications de surface, qu’elles soient physiques et chimiques, comme étant un outil pour améliorer la biocompatibilité et l’adhésion des protéines/cellules, et la création de surfaces à gradient chimique qui permettent l’étude et la manipulation du comportement biologique. Du point de vue de la fabrication, cela signifie que la préparation de surface, telle que le plasma, la silanisation et les couches greffées, doit être un processus validé et reproductible, et non un art.
Dans le domaine de l’ingénierie tissulaire et de la fabrication d’organes biohybrides, la technologie englobe la construction de microarchitectures de supports, les méthodes de stérilisation sans compromettre la fonction biologique, et le contrôle des paramètres des bioréacteurs et des procédures de colonisation cellulaire. Lors de la conception de capsules immunoprotectrices ou d’architectures ouvertes, il est donc nécessaire de contrôler simultanément la diffusion, la perméabilité et la mécanique des parois.
Classes de matériaux
En appliquant les principes ci-dessus aux indications cliniques, en orthopédie, le choix du couple de frottement et de la stratégie de fixation de l’endoprothèse implique un compromis entre l’usure, la stabilité mécanique et la résistance à la fatigue, et l’intégration biologique avec l’os. C’est pourquoi la littérature, sur ce point, a connu un développement intensif dans le domaine des revêtements poreux et bioactifs et des modifications de surface des polymères à poids moléculaire ultra élevé.
En dentisterie, une logique similaire s’applique aux implants et aux restaurations, où les céramiques bio-inertes et bioactives, ainsi que le titane/zircone, sont combinés avec la nécessité de micro- et nano-textures qui favorisent l’ostéointégration et l’étanchéité biologique de la transition muqueuse.
Dans le système cardiovasculaire, la conception des valves et des greffons est directement dérivée de l’hémodynamique et des conséquences procoagulantes de la géométrie et de la rugosité locales.
Dans le domaine rénal, les dispositifs à membrane démontrent comment la théorie de la clairance, de la perméabilité et du transport total se traduit en un régime de traitement réel, en pharmacocinétique des médicaments et en évaluation de l’adéquation de la dialyse, et comment de légères différences dans les membranes, les flux et l’hydraulique entraînent des différences cliniquement significatives. La transposition vers les aspects cliniques nécessite de mettre en correspondance les exigences physiologiques avec les paramètres matériels, géométriques, de transport et de fabrication. Il n’existe donc pas de matériau idéal en dehors du contexte d’une application et d’une charge spécifiques.
L’ouvrage de référence indique nettement la direction de l’évolution. Il s’agit des dispositifs qui intègrent des composants vivants à des structures synthétiques, tels que des organes biohybrides et des prothèses informationnelles, qui fournissent au corps des signaux de remplacement ou modulés, afin de corriger un problème médical.
Certes, il y a des algorithmes de contrôle, mais également des matériaux et des interfaces de surface qui doivent fonctionner de manière prévisible durant des années. Le développement de dispositifs robotiques souples et de capteurs à haute spécificité biologique, enzyme-substrat, antigène-anticorps et ligand-récepteur, exige des concepteurs que ceux-ci maîtrisent les technologies de micro- et nanofabrication, ainsi que la stabilisation des couches actives.
L’ingénierie biomédicale dans le contexte de la science des matériaux – Résumé
La seconde édition de The Biomedical Engineering Handbook fournit une feuille de route complète de l’ingénierie biomédicale, englobant les classes de biomatériaux, les capteurs et les mesures, ainsi que l’ingénierie tissulaire et les organes artificiels. Trois thèmes reviennent tout au long de cette feuille de route. Le premier est la systémicité, car les matériaux, les surfaces, le transport, la mécanique des fluides, l’électronique et les processus de fabrication sont indissociables et déterminent ensemble la sécurité et l’efficacité.
Le second thème est l’évolutivité, impliquant des molécules et des ligands adhésifs aux architectures, de 10 à 100 µm, en passant par les dispositifs complets, les paramètres à une échelle doivent être cohérents avec les exigences des autres.
Le troisième est la fabricabilité, la stérilisation, la propreté, le contrôle de la porosité et de la rugosité, la passivation et les modifications de surface ne sont pas des ajouts, mais des éléments de la conception.
En conséquence, le concepteur biomédical agit comme une sorte de chef d’orchestre, coordonnant les matériaux, les flux, les signaux et les processus, afin de déclencher la réponse biologique souhaitée et d’atteindre une stabilité opérationnelle collective. Cette perspective reste un fondement parfaitement actuel pour les praticiens en biomédecine, en dentisterie et en fabrication de précision.
Bibliographie
Bronzino, J.D. (éd.). The Biomedical Engineering Handbook. Deuxième édition. CRC Press, Boca Raton, 2000.