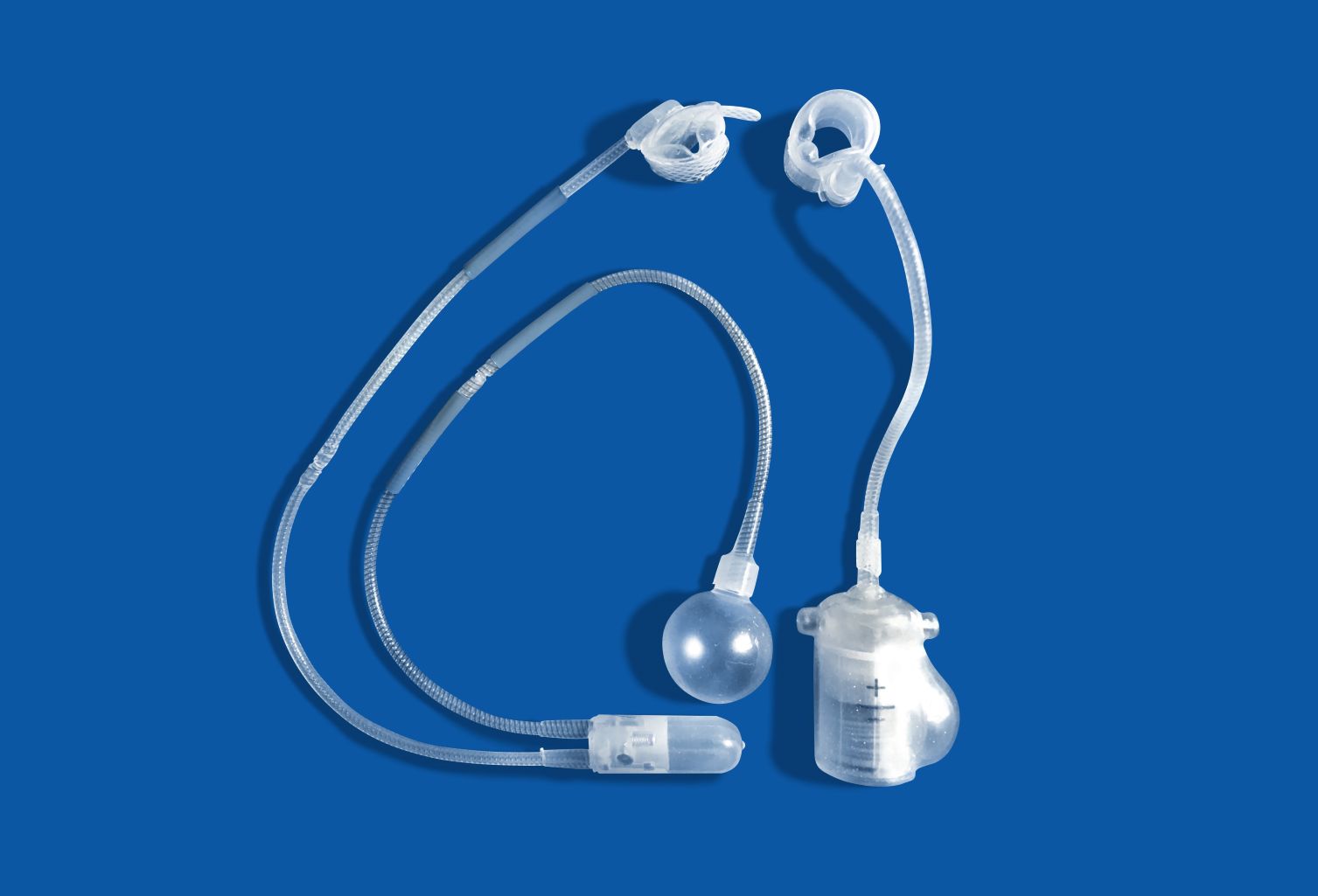
Polimerowe biomateriały
Spis treści
Polimery syntetyczne stały się dziś jedną z najważniejszych grup biomateriałów, obok metali i ceramik. W medycynie wykorzystuje się je w wyrobach jednorazowego użytku, protezach, materiałach dentystycznych, implantach, opatrunkach, urządzeniach pozaustrojowych, systemach kontrolowanego uwalniania leków oraz w inżynierii tkankowej.
Ich pozycja wynika z kilku kluczowych zalet. Polimery są stosunkowo łatwe w przetwórstwie – można z nich wytwarzać lateksy, folie, włókna, rurki, porowate rusztowania i skomplikowane kształty przy użyciu dobrze rozwiniętych technologii przetwórstwa tworzyw. Charakteryzują się szerokim zakresem własności mechanicznych i fizycznych, począwszy od twardych i sztywnych tworzyw konstrukcyjnych, aż po miękkie elastomery i hydrożele. Dodatkowo często są tańsze i lżejsze niż metale oraz łatwiejsze do modyfikacji chemicznej i powierzchniowej.
Wymagania stawiane polimerowym biomateriałom nie różnią się zasadniczo od tych dotyczących innych materiałów implantacyjnych. Oczekuje się od nich przede wszystkim biozgodności (braku działania toksycznego, rakotwórczego, pirogennego czy alergizującego), możliwości sterylizacji typowymi metodami (autoklaw, tlenek etylenu, promieniowanie), a także odpowiednich własności mechanicznych i fizycznych, dostosowanych do funkcji wyrobu oraz dobrej przetwarzalności (możliwość formowania, wytłaczania, wtrysku, formowania włókien).

Podstawy polimeryzacji i budowy polimerów
Polimery powstają w wyniku łączenia małych cząsteczek – monomerów – w długie łańcuchy. Proces ten może zachodzić na drodze polimeryzacji kondensacyjnej (stopniowej) lub polimeryzacji addycyjnej (łańcuchowej, np. wolnorodnikowej).
W polimeryzacji kondensacyjnej (step reaction) każdemu etapowi wzrostu łańcucha towarzyszy wydzielenie małej cząsteczki, najczęściej wody lub alkoholu. Klasycznym przykładem jest tworzenie poliamidów (nylonów) poprzez reakcję grupy aminowej z grupą karboksylową z utworzeniem wiązania amidowego i wydzieleniem wody. W ten sposób powstają m.in. poliestry, poliamidy, poliuretany, polisiloksany, a także naturalne białka i polisacharydy, które również powstają drogą kondensacji, z uwolnieniem cząsteczek wody.
W polimeryzacji addycyjnej, typowej dla wielu tworzyw medycznych, monomer zawiera najczęściej wiązanie podwójne, które ulega rozerwaniu pod wpływem inicjatora – zwykle wolnego rodnika generowanego np. przez nadtlenki (benzoyloperoksyd) w obecności ciepła lub promieniowania UV. Tak powstaje szereg popularnych polimerów, takich jak polietylen, polipropylen, polichlorek winylu, polistyren czy poli(metakrylan metylu).
Struktura makrocząsteczki polimeru decyduje o jego własnościach. Łańcuchy mogą być liniowe, rozgałęzione lub usieciowane. Polimery liniowe (np. klasyczne poliestry czy poliamidy) mogą w znacznym stopniu krystalizować, tworząc układ semikrystaliczny, w którym obszary uporządkowane współistnieją z amorficznymi. Usieciowanie – jak w przypadku elastomerów silikonowych czy gumy naturalnej po wulkanizacji – ogranicza ruchliwość łańcuchów, często uniemożliwia krystalizację i prowadzi do powstania sztywnych sieci trójwymiarowych
.
Własności polimerów silnie zależą od stopnia polimeryzacji, czyli liczby powtarzalnych jednostek w łańcuchu, oraz od miejsca i rozmieszczenia podstawników. Im większa masa cząsteczkowa, tym mniejsza ruchliwość łańcuchów, co przekłada się na większą wytrzymałość i stabilność cieplną, ale także trudniejsze przetwórstwo. Materiał opisuje się zwykle poprzez średnie Mn (masa liczbowo-średnia) i Mw (masa wagowo-średnia), a stosunek Mw/Mn określa polidyspersyjność, istotną dla lepkości stopu i przebiegu procesów przetwórczych.
Kolejnym ważnym parametrem jest takticzność, czyli uporządkowanie podstawników wzdłuż łańcucha. W polimerach winylowych w zależności od rozmieszczenia grup bocznych wyróżnia się konfiguracje izotaktyczne, syndiotaktyczne i ataktyczne. Układy izo- i syndiotaktyczne sprzyjają krystalizacji, nawet jeśli grupy boczne są duże, natomiast konfiguracja ataktyczna prowadzi zwykle do struktury amorficznej, jak w przypadku typowego polistyrenu.
Polimery charakteryzuje się także temperaturami przejść: temperaturą zeszklenia (Tg) oraz temperaturą topnienia (Tm). Poniżej Tg polimer amorficzny zachowuje się jak szkło – sztywnie i krucho, powyżej – jak ciało gumowe lub lepki płyn. Dla polimerów semikrystalicznych Tm opisuje przejście fazy krystalicznej w stan płynny. Położenie Tg i Tm zależy m.in. od masy cząsteczkowej, obecności grup bocznych, stopnia usieciowania i krystaliczności.
Najważniejsze polimery stosowane jako biomateriały
Choć setki polimerów można stosunkowo łatwo otrzymać, w praktyce medycznej powszechnie wykorzystuje się kilkanaście typów, które zyskały dobrą reputację pod względem biozgodności, własności mechanicznych i możliwości sterylizacji.
Polichlorek winylu (PVC) jest amorficznym, sztywnym polimerem, którego łańcuch zawiera duże grupy chlorkowe. Wysoka temperatura zeszklenia (ok. 75–105°C) sprawia, że w stanie czystym jest twardy i kruchy. Dlatego do PVC dodaje się plastyfikatory, np. di-2-etyloheksyloftalan (DEHP), a także stabilizatory termiczne i smary przetwórcze. Skład dodatków decyduje o elastyczności, odporności na ekstrakcję składników przez krew i płyny oraz o stabilności podczas sterylizacji w autoklawie. PVC jest podstawowym materiałem na worki do przechowywania krwi i płynów infuzyjnych, zestawy do infuzji, elementy dializatorów, rurki, cewniki i pojemniki medyczne.
Polietylen (PE) występuje w wielu odmianach: LDPE, HDPE, LLDPE, VLDPE oraz UHMWPE o ultrawysokiej masie cząsteczkowej. Zmieniając warunki polimeryzacji i rodzaj katalizatora, steruje się stopniem rozgałęzienia łańcuchów, krystalicznością i gęstością. LDPE jest bardziej rozgałęziony i miękki, HDPE – liniowy i wysoko krystaliczny. Szczególne znaczenie ma UHMWPE (Mw > 2·10⁶ g/mol), który łączy wysoką odporność na ścieranie, dobre własności mechaniczne i biozgodność, dzięki czemu stosowany jest w endoprotezoplastyce stawów jako panewka biodrowa czy powierzchnia stawowa w protezach kolana.
Polipropylen (PP) ma własności zbliżone do polietylenu, ale dzięki obecności grup metylowych cechuje się nieco wyższą sztywnością i wyższą temperaturą topnienia. Istotną rolę odgrywa tu stereospecyficzna polimeryzacja z katalizatorami Zieglera–Nitty, która daje polimer izotaktyczny. PP wyróżnia się doskonałą odpornością na pękanie naprężeniowe i dużą „żywotnością na zginanie”, dlatego stosuje się go m.in. w strzykawkach jednorazowych, membranach oksygenatorów, szwach chirurgicznych, włókninach i niektórych protezach naczyniowych.
Poli(metakrylan metylu) (PMMA) to amorficzny polimer o wyjątkowej przezroczystości optycznej, wysokim współczynniku załamania światła i dobrej odporności na starzenie atmosferyczne. Jest jednym z najbardziej biozgodnych tworzyw i dlatego od dawna stosuje się go jako materiał na soczewki okularowe i wewnątrzgałkowe, protezy stomatologiczne, elementy pomp krwi, zbiorniki, membrany dializatorów oraz – w postaci kompozytu monomer–proszek – jako „cement kostny” do mocowania protez stawów. Cienko usieciowane pochodne, jak PHEMA czy PAAm, tworzą hydrożele wykorzystywane m.in. w miękkich soczewkach kontaktowych.
Polistyren (PS), otrzymywany metodą polimeryzacji wolnorodnikowej, jest zwykle ataktyczny i amorficzny. W wersji GPPS jest przezroczysty, sztywny i dobrze nadaje się do formowania wtryskowego, natomiast modyfikacja gumowa (HIPS) zwiększa udarność i odporność na pękanie. W biomedycynie PS służy przede wszystkim jako materiał na naczynia do hodowli komórkowej, butle obrotowe, elementy zestawów diagnostycznych i filtracyjnych. Kopolimer ABS, zawierający akrylonitryl i butadien, daje większą odporność chemiczną i lepszą stabilność wymiarową, wykorzystywaną np. w obudowach urządzeń medycznych i elementach dializatorów.
W grupie poliestrowej kluczowe znaczenie ma politereftalan etylenu (PET). Jest to polimer wysoko krystaliczny, o wysokiej temperaturze topnienia, hydrofobowy i odporny na hydrolizę w środowisku słabych kwasów. PET w postaci włókien znany jest jako Dacron® i od lat stosowany w protezach naczyniowych, szwach chirurgicznych, siatkach chirurgicznych oraz elementach zastawek serca.
Poliamidy (nylony) dzięki licznym wiązaniom wodorowym pomiędzy grupami amidowymi tworzą włókna o bardzo dobrej wytrzymałości mechanicznej, idealne do formowania nici. Jednak poliamidy są higroskopijne – chłoną wodę, która pełni rolę plastyfikatora, obniżając moduł sprężystości i wytrzymałość, a w warunkach biologicznych mogą ulegać hydrolizie z udziałem enzymów proteolitycznych. Z tego względu klasyczne nylony tracą z czasem własności w środowisku in vivo i dziś częściej pełnią rolę materiałów na szwy o ograniczonym czasie przebywania w organizmie niż trwałych implantów.
Fluoropolimery, przede wszystkim PTFE (Teflon®), wyróżniają się unikalnym zestawem cech: bardzo wysoką krystalicznością, niskim współczynnikiem tarcia, niewielką energią powierzchniową oraz znakomitą odpornością chemiczną. PTFE ma stosunkowo niską wytrzymałość na rozciąganie, ale może być przetwarzany na drodze spiekania proszków i – po odpowiedniej obróbce – mikroporowany, tworząc strukturę ePTFE. Taki materiał jest szeroko stosowany jako implant naczyniowy, materiał na cewniki oraz elementy wymagające doskonałej ślizgowości i obojętności chemicznej.
Wśród gum i elastomerów szczególne miejsce zajmuje kauczuk silikonowy, zbudowany z łańcuchów polisiloksanowych z grupami metylowymi. W formie usieciowanej tworzy miękki, elastyczny materiał o bardzo dobrej biozgodności, stosowany m.in. w implantach piersi, przewodach stymulatorów serca, drenach i różnych elementach miękkich protez.
Poliuretany można projektować tak, aby uzyskać szeroki zakres modułów – od miękkich elastomerów do sztywnych pianek. W medycynie są wykorzystywane jako powłoki, rurki, elementy urządzeń mechanicznych, a także materiały o zwiększonej odporności na ścieranie w kontakt z krwią i tkankami miękkimi. Dzięki obecności segmentów miękkich i twardych oraz możliwości chemicznej modyfikacji, poliuretany są jednym z najbardziej wszechstronnych polimerów dla zastosowań biomedycznych.
Kolejną grupę tworzą polimery wysokowytrzymałe: poliacetale (POM, Delrin®), polisulfoniany (Udel®) i polikarboniany (Lexan®). Mają one sztywne łańcuchy główne, wysoką odporność termiczną i chemiczną oraz dobre własności mechaniczne. Z tego powodu znajdują zastosowanie w elementach konstrukcyjnych urządzeń medycznych, komponentach pomp, zastawek, obudowach, a części z nich są badane jako potencjalne tworzywa implantacyjne.
Coraz większe znaczenie mają polimery biodegradowalne, w szczególności PLA, PGA, kopolimery PLGA, polidioksanon, polialkanolaktany i karbonaty. Są to najczęściej poliestry z grupy α-hydroksykwasów, które ulegają degradacji przez hydrolizę wiązań estrowych, prowadząc do metabolitów włączanych do cyklu Krebsa (kwas mlekowy, glikolowy) i ostatecznie wydalanych w postaci dwutlenku węgla i wody. Czas degradacji PLGA można regulować składem kopolimeru i parametrami przetwórstwa, co czyni go doskonałym materiałem na rusztowania dla inżynierii tkankowej oraz nośniki leków w postaci mikrosfer. PGA sprawdza się jako wchłanialny szew i materiał na siatki chirurgiczne, natomiast PLA dzięki wyższej sztywności może pełnić rolę czasowych elementów nośnych w osteosyntezie.
Sterylizacja polimerowych biomateriałów
W przeciwieństwie do metali i wielu ceramik, polimery mają ograniczoną odporność termiczną i chemiczną, co czyni dobór metody sterylizacji kluczowym etapem projektowania wyrobu medycznego.
Sterylizacja suchym powietrzem, prowadzona w temperaturze rzędu 160–190°C, jest odpowiednia jedynie dla polimerów o bardzo wysokiej stabilności cieplnej, takich jak PTFE czy silikon. Dla większości tworzyw, w tym polietylenu czy PMMA, temperatury te przekraczają punkty mięknięcia i topnienia, prowadząc do deformacji i degradacji.
Autoklawowanie, czyli sterylizacja parą wodną pod ciśnieniem w temperaturze około 125–130°C, jest łagodniejsze cieplnie, ale stawia inne wymagania: materiał musi być odporny na działanie gorącej wody i pary. Polimery podatne na hydrolizę, takie jak niektóre poliamidy, PVC czy POM, mogą ulegać degradacji lub pękaniu naprężeniowemu i nie nadają się do powtarzalnej sterylizacji parowej.
Bardzo często stosuje się gazowy tlenek etylenu, który pozwala sterylizować wyroby w niskiej temperaturze. Choć jest to metoda relatywnie łagodna dla materiału, wymaga kontroli pozostałości gazu oraz odpowiednio długiej aeracji. Niektóre polimery mogą jednak ulegać stopniowej degradacji lub odbarwieniu nawet w takich warunkach.
Sterylizacja radiacyjna, z użyciem źródeł Co-60, jest bardzo skuteczna, lecz promieniowanie jonizujące może powodować scission (pękanie łańcuchów) lub dodatkowe usieciowanie, w zależności od struktury polimeru. W polietylenie wysoka dawka prowadzi do powstania twardego, kruchego materiału w wyniku jednoczesnego cięcia łańcuchów i ich łączenia. Polipropylen z kolei jest podatny na odbarwienie i kruchość po napromienieniu, przy czym degradacja własności może postępować z czasem po sterylizacji. Dlatego dla niektórych zastosowań unika się dodatków wrażliwych na promieniowanie i dobiera skład tak, aby zminimalizować niekorzystne efekty.

Modyfikacje powierzchni
Ponieważ większość interakcji biologicznych zachodzi na pierwszych nanometrach powierzchni, kluczowym narzędziem inżynierii polimerów jest modyfikacja warstwy wierzchniej, często bez istotnej zmiany właściwości objętościowych.
W urządzeniach mających kontakt z krwią – dializatorach, protezach naczyniowych, sztucznych zastawkach, układach krążenia pozaustrojowego – najważniejszym problemem jest zakrzepica i adhezja płytek krwi. Klasycznym podejściem jest immobilizacja heparyny i jej analogów na powierzchni polimeru. Heparyna, będąca kwaśnym glikozaminoglikanem, hamuje kaskadę krzepnięcia, jednak trwałe związanie jej z powierzchnią jest trudne, a powolne uwalnianie może być zarazem pożądane, jak i problematyczne – zbyt szybkie „obrośnięcie” powierzchni warstwą białek osocza może zmniejszyć dostępność heparyny dla krwi.
Inną strategią jest tworzenie powierzchni preferencyjnie adsorbujących albuminę, co obserwuje się jako zjawisko związane ze zmniejszoną adhezją płytek. Pokrycia z fibryonektyny stosuje się z kolei tam, gdzie celem jest zasiedlenie powierzchni przez komórki śródbłonka, np. w próbach tworzenia „biologicznych” powierzchni naczyniowych na syntetycznych graftach. Powłoki z alginianu, ze względu na dobrą biozgodność i możliwość kontrolowanej degradacji, testowano jako warstwy poprawiające kompatybilność protez naczyniowych.
Dużą grupę stanowią modyfikacje fizykochemiczne, które zmieniają zwilżalność, energię powierzchniową, ładunek oraz topografię. Stosuje się m.in. obróbki plazmowe (plazma tlenowa, azotowa, fluorową), naparowywanie cienkich powłok krzemowych i fluoropolimerowych, graftowanie hydrożeli czy implantację jonów. Celem może być zarówno zwiększenie odporności na ścieranie i korozję (np. powłoki diamentowe, anodowanie), jak i kontrola adsorpcji białek oraz adhezji komórek.
Przykładowo, powłoki z polietylenooksydu (PEO) znacząco ograniczają adsorpcję białek i przyczepianie się komórek, co czyni je obiecującymi kandydatami na powierzchnie „antyadhezyjne” dla krwi i komórek. Z kolei powłoki hydrofilowe, o dobranym stosunku oddziaływań polarnych i dyspersyjnych, mogą sprzyjać adsorpcji białek „pasywnych” i zmniejszać aktywację płytek.
Interesującą koncepcją jest także metoda perfuzji solanką przez ścianki porowatych rurek. Dzięki przepływowi roztworu soli przez mikropory tworzy się cienka warstwa płynu oddzielająca krew od materiału, co może znacząco ograniczyć adhezję komórek i powstawanie skrzepów. Metodę tę badano m.in. na porowatych rurkach z PE, ePTFE, polisulfonu i ceramiki tlenkowej, uzyskując obiecujące wyniki zarówno in vitro, jak i in vivo.
Powierzchnie chemogradientowe
Klasyczne badania wpływu właściwości powierzchni na zachowanie komórek czy białek wymagają przygotowania wielu próbek o różnych modyfikacjach, co jest czasochłonne i wrażliwe na zmienność biologiczną. Odpowiedzią na ten problem są powierzchnie chemogradientowe – podłoża, na których właściwości zmieniają się stopniowo wzdłuż jednej osi.
W przypadku polimerów opracowano metody tworzenia gradientów zwilżalności na podłożach z polietylenu, wykorzystując plazmę RF lub wyładowania koronowe. Arkusz polimeru przesuwa się pod elektrodą tak, aby czas ekspozycji na plazmę stopniowo się zmieniał. Im dłuższa ekspozycja, tym większa zawartość tlenowych grup polarnych na powierzchni i tym niższy kąt zwilżania wodą, co odpowiada większej hydrofilowości. W ten sposób można uzyskać powierzchnię, na której kąt zwilżania spada płynnie np. z 95° do 45° na długości kilku centymetrów.
Tego typu podłoża wykorzystano do badania adhezji i proliferacji różnych typów komórek, m.in. komórek jajnika chomika chińskiego (CHO), fibroblastów oraz komórek śródbłonka. Okazało się, że maksymalna adhezja, rozprzestrzenianie i wzrost przypadały na obszar o średniej hydrofilowości, odpowiadający kątowi zwilżania około 50–55°. Zarówno bardzo hydrofobowe, jak i bardzo hydrofilowe fragmenty powierzchni wykazywały gorszą kolonizację komórkową.
Podobny trend zaobserwowano w przypadku adsorpcji białek surowicy. Maksymalna ilość białek, w tym fibryonektyny i witronaktyny, adsorbowała się również w obszarze o pośredniej zwilżalności, co koreluje z optymalną adhezją i wzrostem komórek. Wynika z tego, że z punktu widzenia inżynierii powierzchni istnieje „okno” zwilżalności, w którym jednocześnie sprzyja się korzystnej adsorpcji białek adhezyjnych i zachowaniu komórek.
Technikę chemogradientów rozszerzono następnie na gradienty grup funkcyjnych – na przykład –COOH, –CH₂OH, –CONH₂ czy –CH₂NH₂ – otrzymywane przez kombinację obróbki koronowej, graftowania monomerów winylowych i reakcji podstawienia. Pozwoliło to badać wpływ ładunku powierzchniowego, gęstości grup jonizowalnych czy polarności na zachowanie komórek, adhezję płytek krwi i adsorpcję białek, nadal w jednym eksperymencie.
Tak przygotowane powierzchnie chemogradientowe stanowią potężne narzędzie do szybkiego mapowania zależności między właściwościami powierzchni a odpowiedzią biologiczną, ograniczając liczbę próbek i zmniejszając rozrzut wyników wynikający z różnic pomiędzy seriami komórkowymi czy warunkami hodowli. W przyszłości podobne koncepcje mogą zostać zastosowane w urządzeniach separacyjnych, biosensorach oraz „bibliotekach” powierzchni do wysokoprzepustowego screeningu biomateriałów.
Podsumowanie – Polimerowe biomateriały
Polimerowe biomateriały stanowią niezwykle zróżnicowaną grupę tworzyw, obejmującą twarde, konstrukcyjne termoplasty (PE, PP, PET, POM, polisulfony, polikarbonaty), miękkie elastomery (silikony, poliuretany), hydrożele (PHEMA, PAAm), fluoropolimery (PTFE) oraz coraz ważniejsze polimery biodegradowalne (PLA, PGA, PLGA, polidioksanon). Dzięki możliwości precyzyjnego kształtowania struktury łańcuchowej, masy cząsteczkowej, stopnia usieciowania i krystaliczności, można projektować materiały idealnie dopasowane do wymagań konkretnych zastosowań – od jednorazowych zestawów infuzyjnych po długotrwałe implanty i systemy kontrolowanego uwalniania leków.
Kluczowym wyzwaniem pozostaje sterilizacja oraz kontrola interakcji powierzchni z krwią i tkankami. Wymaga to nie tylko wyboru odpowiedniego polimeru, ale również świadomego doboru metody sterylizacji i – co szczególnie istotne – modyfikacji powierzchni, aby osiągnąć pożądany profil biozgodności. Nowoczesne techniki, takie jak obróbka plazmowa, powłoki hydrofilowe i hydrofobowe, immobilizacja biomolekuł, graftowanie hydrożeli czy projektowanie chemogradientowych powierzchni, otwierają drogę do bardziej precyzyjnego sterowania odpowiedzią biologiczną.
W efekcie polimery nie są już tylko „plastikiem w medycynie”, lecz wysoce inżynierskimi narzędziami, które można dopasować pod względem składu, struktury i powierzchni do wymagań konkretnego zadania klinicznego. Połączenie tej elastyczności z rosnącą wiedzą o interakcjach komórka–materiał sprawia, że polimerowe biomateriały będą prawdopodobnie odgrywać jeszcze większą rolę w przyszłości implantologii, inżynierii tkankowej i technologii medycznych.