Was ist Metallkristallisation?
Inhaltsverzeichnis
Die Kristallisation ist ein grundlegendes physikalisch-chemisches Phänomen in Metallen. Sie spielt sowohl bei deren Herstellung als auch bei deren Weiterverarbeitung eine entscheidende Rolle. Dieser Prozess, bei dem Metall durch die Anordnung von Atomen in einer regelmäßigen Kristallstruktur vom flüssigen in den festen Zustand übergeht, bestimmt die Struktur und die Eigenschaften des entstehenden Materials. Je nach Erstarrungsbedingungen wie Temperatur, Abkühlgeschwindigkeit und Vorhandensein von Verunreinigungen kann Metall unterschiedliche Kristallformen annehmen, die sich wiederum unter anderem auf seine Festigkeit, seine Eignung für die weitere Verarbeitung und seine chemischen Eigenschaften auswirken.
Insbesondere in Bereichen wie Metallurgie, Gießereiwesen, Werkstofftechnik und Verbindungstechnik ist das Verständnis der Kristallisationsmechanismen von großer Bedeutung. Die praktischen Anwendungen dieses Wissens reichen von der Herstellung von Stahl und Speziallegierungen bis hin zur kontrollierten Gestaltung der Mikrostruktur von Werkstoffen für die Luftfahrtindustrie und Kernenergie. Dieser Artikel gibt einen Überblick über die physikalischen und kinetischen Grundlagen des Kristallisationsprozesses von Metallen. Dabei stützt er sich sowohl auf theoretische Erkenntnisse als auch auf praktische Beobachtungen.

Energetische Grundlagen von Phasenübergängen
Metalle können wie andere Stoffe in drei Aggregatzuständen vorliegen: fest, flüssig und gasförmig. Der Übergang von einem Zustand in einen anderen erfolgt unter genau definierten Temperatur- und Druckbedingungen, die für jedes Element charakteristisch sind. Unter atmosphärischem Druck sind der Schmelzpunkt und der Siedepunkt besonders wichtig, da sie grundlegende physikalische Eigenschaften von Metallen sind.
Aus thermodynamischer Sicht laufen Prozesse nur dann spontan ab, wenn dabei die freie Energie des Systems verringert wird. Daher wird die freie Energie der in einem bestimmten System gebildeten Phase als geringer als die der vorhergehenden Phase beschrieben. Die Stabilität einer bestimmten Phase unter bestimmten Bedingungen ist umso größer, je geringer die freie Energie ist.
Für den Kristallisationsprozess ist es entscheidend, die freie Energie der flüssigen und festen Phase zu vergleichen. Unterhalb der Kristallisationstemperatur (d. h. dem Gefrierpunkt) ist die feste Phase stabiler, da ihre freie Energie geringer ist. Oberhalb dieser Temperatur ist die flüssige Phase stabiler. Wenn beide freien Energien am Übergangspunkt, der theoretischen Kristallisationstemperatur, gleich sind, dann existieren Flüssigkeit und Feststoff in einem Gleichgewichtszustand nebeneinander.
Damit die Kristallisation beginnen kann, muss die Flüssigkeit jedoch unter ihren theoretischen Gefrierpunkt unterkühlt werden. Die Temperatur, bei der es zu einer Verfestigung kommt, ist niedriger als die theoretische Temperatur. Dieser Unterschied heißt Unterkühlungsgrad. Beim Schmelzen kann es zu einer Überhitzung kommen, d. h. die Übergangstemperatur kann sich gegenüber dem theoretischen Gleichgewichtspunkt nach oben verschieben.
Phasenübergänge gehen auch mit thermischen Effekten einher – im Falle der Verfestigung ist dies die Freisetzung von latenter Wärme und im Falle des Schmelzens deren Absorption. Auf Heiz- und Kühlungsdiagrammen erscheinen dank dieses Phänomens charakteristische horizontale Abschnitte, die die stattfindenden Umwandlungen anzeigen. Der Kristallisationsprozess kann über die Zeit beobachtet und analysiert werden, wofür es Diagramme gibt.
In der Praxis wird auch eine thermische Hysterese beobachtet – ein Phänomen, bei dem die Übergangstemperatur beim Erhitzen von der Übergangstemperatur beim Abkühlen abweicht. Dies ist eine direkte Folge der Unterkühlung bzw. Überhitzung der Flüssigkeit. Je langsamer die Abkühlung erfolgt, desto geringer ist der Unterkühlungsgrad und desto näher kommt der Prozess der Theorie.
Kristallkeimbildung und -wachstum
Die Primärkristallisation, also die Umwandlung von flüssigem Metall in einen festen Zustand, findet in zwei Stufen statt. Zunächst bilden sich stabile Kristallkeime, aus denen sich anschließend die Kristalle weiterentwickeln.
Die Keimbildung findet nur statt, wenn die Gesamtenergie des Systems abnimmt. Einerseits bewirkt der Übergang von der flüssigen in die feste Phase eine Abnahme der freien Energie, was die Kristallisation begünstigt. Andererseits entsteht durch die Bildung einer Grenzfläche zwischen der Flüssigkeit und dem Kristall zusätzliche Oberflächenenergie, die den gegenteiligen Effekt hat – sie erhöht die Energie des Systems.
Die Kristallisation erfolgt, wenn die Reduktion der freien Energie, die mit der Struktur der Atome assoziiert ist, größer ist als die Zunahme der Energie, die durch die Entstehung der Embryooberfläche entsteht. Das Gleichgewicht dieser Energien wird durch die folgende Formel beschrieben:
\[ \Delta F = -\Delta F_V \cdot V + \sigma \cdot A\]
- \(\Delta F_V\) – Differenz der freien Energie pro Volumeneinheit,
- \(V\) – Embryovolumen,
- \(\sigma\) – Oberflächenspannung,
- \(A\) – Oberfläche des Keims.
Unter der Annahme, dass der Kern eine sphärische Form hat, lässt sich der kritische Radius des Kerns (rk) berechnen, der die Grenze zwischen stabilen und instabilen Kernen bestimmt:
\[r_k = \frac{2\sigma}{\Delta F_V}\]
Nur Kerne mit einem Radius gleich oder größer als rk sind stabil und können zu vollwertigen Kristallen heranwachsen. Kerne kleiner als rk lösen sich wieder in die Flüssigkeit auf, da ihre Existenz mit einer Erhöhung der Energie des Systems verbunden wäre.
Die Größe von rk wird entscheidend durch den Grad der Unterkühlung der Flüssigkeit beeinflusst. Je größer die Unterkühlung, desto größer ist der Unterschied in der freien Energie zwischen der Flüssigkeit und den Kristallen und desto kleiner ist der kritische Radius. Die Folge ist, dass sich stabilere Kerne bilden, was wiederum zu einer schnelleren Kristallisation und einer feineren Metallstruktur führt.
Das Vorhandensein von fremden Feststoffeinschlüssen in der Flüssigkeit kann ebenfalls die Keimbildung induzieren. Die lokale Oberflächenspannung kann durch solche Partikel (z. B. Oxide, Nitride, Risse in der Form) verringert werden und eine heterogene Keimbildung kann auch bei geringerer Unterkühlung begünstigt werden.
Gleichzeitig mit der Keimbildung findet das Kristallwachstum statt. Bei diesem Prozess lagern sich nacheinander Atomschichten an die Oberfläche des Keims an. Schraublagen sind dabei von besonderer Bedeutung, da sie den Wachstumsprozess erleichtern. An diesen Stellen bildet sich eine spiralförmige Verwerfung, die zusätzliche Atome anzieht. Das führt zu einem kontinuierlichen und effektiven Kristallwachstum. Dieses Phänomen wurde von F. C. Frank beschrieben und als Wachstumsspirale bekannt.
Faktoren, die die Kristallisation beeinflussen
Der Metallkristallisationsprozess basiert auf den Prinzipien der Thermodynamik und Kinetik. Unter realen industriellen Bedingungen wird er jedoch von vielen externen Variablen beeinflusst. Diese Faktoren beeinflussen sowohl die Anzahl der gebildeten Kristallkeime als auch die Geschwindigkeit des Kristallwachstums, was sich direkt auf die endgültige Struktur des erstarrten Metalls auswirkt. Zu den wichtigsten Faktoren gehören:
- Die Temperatur des Metalls vor dem Gießen und die Zeit, die es bei dieser Temperatur gehalten wird – bei hohen Temperaturen und langer Zeit besteht die beste Möglichkeit, Verunreinigungen zu entfernen. Außerdem sind dann die Erstarrungsbedingungen am homogensten.
- Die Gießtemperatur beeinflusst den Grad der Unterkühlung, der wiederum die Anzahl der Keime und die Kornstruktur beeinflusst.
- Gießverfahren – Methoden wie Schwerkraftguss, Siphon-Guss oder Richtungsguss wirken sich auf die Temperaturverteilung in der Form aus und steuern auf diese Weise den Kristallisationsprozess.
- Abkühlgeschwindigkeit – Struktur des Endprodukts hängt maßgeblich von den Bedingungen während der Abkühlung ab. Eine schnelle Abkühlung fördert eine feinkörnige Struktur, während eine langsame Abkühlung zu einer grobkörnigen Struktur führt.
- Art und Temperatur der Gussform – Eine Form aus gut wärmeleitenden Materialien (z. B. Metall) und eine kühle Form beschleunigen die Wärmeübertragung und erhöhen die Unterkühlung der Flüssigkeit.
- Qualität des flüssigen Metalls – Das Vorhandensein von nichtmetallischen Einschlüssen kann die Keimbildung erheblich beeinflussen. Beispiele für solche Einschlüsse sind Oxide oder Sulfide. Dadurch verändert sich auch die Beschaffenheit der gebildeten Körner.
- Oberflächenspannung des Metalls bei der Erstarrungstemperatur – bestimmt die Leichtigkeit der Bildung einer Phasengrenzfläche zwischen der Flüssigkeit und dem Keim.
- Mechanische Stöße, Vibrationen und Ultraschallwellen können die Anzahl der Keime erhöhen und die Kristallisation beschleunigen, wodurch die Struktur und Homogenität des Materials beeinflusst werden.
Obwohl die Zusammenhänge zwischen diesen Faktoren und dem Verlauf der Kristallisation theoretisch bekannt sind, sind ihre Wechselwirkungen in der Praxis komplex und schwer mit Sicherheit vorherzusagen. Es gibt keine einheitliche Theorie, die alle Variablen gleichzeitig berücksichtigt.
Um die Beschreibung des Kristallisationsprozesses zu vereinfachen, schlug G. Tammann zwei Parameter vor:
- Die Anzahl der Kristallkeime, die sich innerhalb einer Minute spontan in einem Volumeneinheit bilden.
- Lineare Kristallisationsgeschwindigkeit, d. h. die Wachstumsgeschwindigkeit der Kristalle, gemessen in Millimetern pro Minute.
Der Grad der Unterkühlung der Flüssigkeit hat einen direkten Einfluss auf beide Größen. Mit abnehmender Temperatur erhöhen sich anfänglich sowohl die Menge der Mikroorganismen als auch die Geschwindigkeit der Kristallisation, erreichen einen Höhepunkt und nehmen dann wieder ab. In extremen Fällen, bei sehr hoher Unterkühlung, erstarrt die Flüssigkeit als amorpher Körper.
Die Abkühlgeschwindigkeit wird oft als annäherndes Äquivalent zum Unterkühlungsgrad behandelt, sodass sie in der Praxis als Werkzeug zur Steuerung der Materialstruktur eingesetzt werden kann.

Kristallform und Struktur von Gussteilen
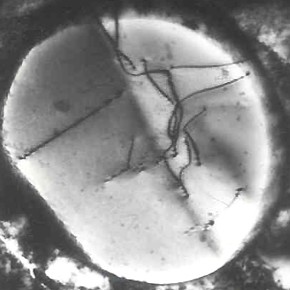
Während der Kristallisation bilden sich aus der Flüssigkeit Kristalle unterschiedlicher Form, abhängig von den thermischen und räumlichen Bedingungen, unter denen die Erstarrung stattfindet. Die häufigste Kristallform in Metallen sind Dendriten. Das sind verzweigte Strukturen, die an Bäume erinnern. Ihr Name stammt vom griechischen Wort „dendron” (Baum).
Dendritische Kristalle entstehen, weil das Kristallwachstum in Richtung der Wärmeabgabe schneller erfolgt, meist senkrecht zu den Wänden der Form. Zunächst bildet sich die Hauptachse der Dendriten (Primärstruktur), aus der sich in einem Winkel Sekundärzweige entwickeln, gefolgt von Tertiärzweigen, wodurch eine charakteristische Struktur entsteht. Mit fortschreitender Kristallisation verlängern und verdicken sich die Dendriten, bis sie sich berühren, wodurch ihr weiteres Wachstum gestoppt wird.
Sobald die Dendriten ihr Wachstum beendet haben, werden die Zwischenräume zwischen den Dendriten mit dem restlichen flüssigen Metall gefüllt, das die leeren Bereiche ausfüllt und ebenfalls erstarrt. Dadurch verwandeln sich die Dendriten in kristalline Körner, und die endgültige Struktur des Metalls besteht aus dicht gepackten Körnern.
Unter bestimmten Voraussetzungen, nämlich wenn nicht genügend flüssiges Metall zur Verfügung steht (was beispielsweise durch Schrumpfung während der Erstarrung oder durch Porosität bedingt sein kann), ist es nicht möglich, die Dendriten auszufüllen. Sie bleiben dann sichtbar und sind beispielsweise in Schrumpfhohlräumen zu beobachten. Es sind Fälle bekannt, in denen riesige Dendriten gefunden wurden, beispielsweise der sogenannte Chernov-Kristall, der 39 cm lang ist und in der Schrumpfhohlraum eines 100-Tonnen-Barrens entdeckt wurde.
Basierend auf Beobachtungen der Stahlverfestigung in einer Form lassen sich drei Hauptkristallisationszonen im Querschnitt des Blocks unterscheiden:
- Gefrorene Kristallzone – eine dünne Metallschicht an den Formwänden, die aufgrund starker Unterkühlung sofort erstarrt. Sie besteht aus sehr feinen, chaotisch angeordneten Kristallen.
- Säulenkristallzone – dieser Effekt entsteht, wenn die Kristalle sich von den Formwänden aus in das Metall hineinwachsen. Die Kristalle weisen eine längliche Form auf und stehen vertikal zu den Wänden, in der Richtung, in der die Wärme übertragen wird.
- Freie Kristallzone – befindet sich im mittleren Teil des Blocks, wo kein gerichteter Wärmefluss stattfindet. Dort bilden sich wenige, größere und chaotisch angeordnete Kristalle, die manchmal auf den Boden der Flüssigkeit sinken.
Mit zunehmender Kristallisation verändert sich auch die chemische Zusammensetzung der Restflüssigkeit. Die ersten Kristalle, die sich bilden, sind relativ rein, während sich Verunreinigungen (z. B. Schwefel, Phosphor, Kohlenstoff) zuletzt in der erstarrenden Flüssigkeit konzentrieren. Das passiert in der Regel im oberen Teil des Barrens, also der Vertiefung, in der Nähe des Hohlraums, der sich zurückzieht. Dieses Phänomen wird als makroskopische Entmischung bezeichnet, im Gegensatz zur mikroskopischen Entmischung, die innerhalb einzelner Körner auftritt.
Je nach Grad der Desoxidation und Entgasung des Stahls werden verschiedene Arten der Erstarrung unterschieden:
- Abgeschossene Stähle – gut entgast, erstarren ruhig, mit wenigen Gasblasen. Sie weisen bessere Eigenschaften und einen geringeren Verunreinigungsgehalt auf.
- Nicht abgeschossene Stähle – „kochen” während der Erstarrung intensiv, mit einer großen Anzahl von Blasen, deren Struktur an Schweizer Käse erinnert. Ihre Ausbeute ist höher, aber ihre Eigenschaften sind schlechter.
- Halbgekühlte Stähle – sie fallen in die Kategorie zwischen den zuvor aufgeführten Varianten und werden beispielsweise mittels teilweiser Desoxidation, etwa mit Mangan und Aluminium, produziert.
Umwandlungen im festen Zustand
Je nach Temperatur und Druck können einige Metalle unterschiedliche Kristallstrukturen annehmen. Dieses Phänomen wird als Polymorphismus oder Allotropie bezeichnet. Das bedeutet, dass dasselbe Element in mehreren verschiedenen Strukturformen kristallisieren kann. Diese unterscheiden sich in der Art des räumlichen Netzwerks.
Die einzelnen allotropen Varianten werden mit griechischen Buchstaben bezeichnet: α, β, γ usw., die als Indizes zum chemischen Symbol hinzugefügt werden. Typischerweise ist die α-Variante bei den niedrigsten Temperaturen stabil, während die anderen Formen erst mit steigender Temperatur entstehen.
Jede Variante hat ihre eigenen charakteristischen physikalischen, chemischen und mechanischen Eigenschaften. Der Prozess, bei dem eine Struktur in eine andere übergeht – zum Beispiel von hexagonal zu regelmäßig – wird als Sekundärkristallisation bezeichnet. Er ist mit der Kristallisation aus einer Flüssigkeit vergleichbar. Dabei geschieht Folgendes:
- Keimbildung (Entstehung einer neuen Phase),
- Wachstum neuer Kristalle in einer bereits festen Struktur.
Da allotropische Umwandlungen in einer festen Umgebung stattfinden, können sie einen Teil der kristallographischen Orientierung der vorherigen Phase beibehalten, was beispielsweise bei der Wärmebehandlung von Metallen wichtig ist. Diese Umwandlungen gehen oft mit thermischen Effekten einher: Wärmeabgabe beim Abkühlen und Wärmeaufnahme beim Erhitzen.
In Temperaturdiagrammen manifestiert sich dies als „Temperaturstopps”, ähnlich wie beim Schmelzen oder Erstarren.
Allotrope Phänomene sind aus technologischer Sicht wichtig, da sie die Eigenschaften eines Materials, wie beispielsweise Festigkeit, Härte oder Wärmeausdehnung, verändern. Aus diesem Grund wird der kontrollierte Übergang zwischen allotropen Formen von vielen thermischen Prozessen (z. B. Härten oder Glühen) genutzt.
Allotrope Umwandlungen neigen auch zu Überhitzung oder Unterkühlung, was in der Praxis bedeutet, dass sie möglicherweise nicht genau bei der Gleichgewichtstemperatur, sondern etwas darüber stattfinden.
Was ist Metallkristallisation – Zusammenfassung
Der Prozess der Metallkristallisation ist ein komplexes physikalisch-chemisches Phänomen, das von vielen thermodynamischen und kinetischen Faktoren abhängt. Von entscheidender Bedeutung sind dabei die freie Energie, der Grad der Unterkühlung, die Kühlbedingungen sowie das Vorhandensein von Kristallkeimen und deren Wachstumsfähigkeit.
Wenn man die Prinzipien der Kristallisation versteht, kann man die Mikrostruktur eines Metalls steuern. Das wiederum beeinflusst die mechanischen, technologischen und funktionellen Eigenschaften des Metalls. Dieses Wissen wird in verschiedenen Bereichen angewendet, wie zum Beispiel in der Gießerei, der Metallurgie, der Legierungstechnik, dem Schweißen und der Wärmebehandlung.
Das Beispiel Eisen verdeutlicht, wie unterschiedliche strukturelle und magnetische Eigenschaften das Verhalten eines Materials in Abhängigkeit von der Temperatur beeinflussen. Daher werden Kenntnisse über den Kristallisationsprozess und Phasenübergänge für die Werkstofftechnik als grundlegend angesehen und in der industriellen Praxis als unverzichtbar erachtet.