Czym jest krystalizacja metali?
Spis treści
Krystalizacja to jedno z podstawowych zjawisk fizykochemicznych zachodzących w metalach, odgrywające kluczową rolę zarówno w ich wytwarzaniu, jak i dalszym przetwarzaniu. Proces ten, polegający na przejściu metalu ze stanu ciekłego do stałego poprzez uporządkowanie atomów w regularne struktury krystaliczne, decyduje o strukturze i właściwościach uzyskanego materiału. W zależności od warunków krzepnięcia – takich jak temperatura, szybkość chłodzenia, obecność wtrąceń – metal może przybierać różne formy krystaliczne, co wpływa m.in. na jego wytrzymałość, podatność na dalszą obróbkę czy właściwości chemiczne.
Zrozumienie mechanizmów krystalizacji ma szczególne znaczenie w takich dziedzinach jak metalurgia, odlewnictwo, inżynieria materiałowa oraz technologia spajania. Praktyczne zastosowania tej wiedzy sięgają od produkcji stali i stopów specjalnych, po kontrolowane kształtowanie mikrostruktury materiałów wykorzystywanych w przemyśle lotniczym czy energetyce jądrowej. Niniejszy artykuł ma na celu przybliżenie zasad fizycznych i kinetycznych rządzących procesem krystalizacji metali, w oparciu o wiedzę teoretyczną oraz obserwacje praktyczne.

Energetyczne podstawy przemian fazowych
Metale, podobnie jak inne substancje, mogą występować w trzech stanach skupienia: stałym, ciekłym i gazowym. Przemiana jednego stanu w drugi zachodzi w ściśle określonych warunkach temperatury i ciśnienia, charakterystycznych dla każdego pierwiastka. W warunkach ciśnienia atmosferycznego szczególne znaczenie mają temperatura topnienia oraz temperatura wrzenia, które są fundamentalnymi parametrami fizycznymi metali.
Z punktu widzenia termodynamiki, samorzutnie przebiegają tylko te procesy, które prowadzą do zmniejszenia energii swobodnej układu. W związku z tym, faza powstająca w danym układzie ma niższą energię swobodną niż faza poprzedzająca. Im niższa energia swobodna, tym większa trwałość danej fazy w danych warunkach.
Dla procesu krystalizacji kluczowe jest porównanie energii swobodnej fazy ciekłej i stałej. Poniżej temperatury krystalizacji (czyli temperatury krzepnięcia), bardziej trwałą fazą jest ciało stałe, ponieważ jego energia swobodna jest mniejsza. Powyżej tej temperatury trwałość wykazuje faza ciekła. W punkcie przejściowym, czyli w teoretycznej temperaturze krystalizacji, obie energie swobodne są sobie równe, co oznacza, że ciecz i ciało stałe współistnieją w stanie równowagi.
Aby jednak rozpocząć krystalizację, ciecz musi zostać przechłodzona poniżej teoretycznej temperatury krzepnięcia. Różnica między temperaturą teoretyczną a rzeczywistą, przy której rozpoczyna się krzepnięcie, nosi nazwę stopnia przechłodzenia. Analogicznie, podczas topnienia może dojść do przegrzania, czyli przesunięcia temperatury przemiany w górę względem teoretycznego punktu równowagi.
Przemianom fazowym towarzyszą również efekty cieplne – w przypadku krzepnięcia jest to wydzielanie ciepła utajonego, a przy topnieniu – jego pochłanianie. Dzięki temu zjawisku na wykresach nagrzewania i chłodzenia pojawiają się charakterystyczne poziome odcinki, które wskazują na zachodzące przemiany. Takie wykresy pozwalają obserwować i analizować przebieg krystalizacji w czasie.
W praktyce obserwuje się również histerezę cieplną – zjawisko, w którym temperatura przemiany przy nagrzewaniu różni się od temperatury przemiany przy chłodzeniu. Wynika to bezpośrednio z przechłodzenia i przegrzania cieczy. Im wolniejsze chłodzenie, tym mniejszy stopień przechłodzenia i bardziej zbliżony przebieg procesu do teorii.
Zarodkowanie i wzrost kryształów
Proces krystalizacji pierwotnej, czyli przejścia ciekłego metalu w ciało stałe, przebiega dwuetapowo. Składa się on z powstawania trwałych zarodków krystalicznych oraz wzrostu kryształów z istniejących już zarodków.
Tworzenie się zarodków następuje tylko wtedy, gdy całkowita energia układu ulega zmniejszeniu. Z jednej strony przejście z fazy ciekłej do stałej powoduje spadek energii swobodnej, co sprzyja krystalizacji. Z drugiej strony jednak, powstanie powierzchni rozdziału między cieczą a kryształem generuje dodatkową energię powierzchniową, która działa przeciwnie – zwiększa energię układu.
Krystalizacja następuje wtedy, gdy zmniejszenie energii swobodnej związanej z uporządkowaniem atomów jest większe niż wzrost energii wynikający z powstania powierzchni zarodka. Bilans tych energii opisuje wzór:
\[ \Delta F = -\Delta F_V \cdot V + \sigma \cdot A\]
- \(\Delta F_V\) – różnica energii swobodnej na jednostkę objętości,
- \(V\) – objętość zarodka,
- \(\sigma\) – napięcie powierzchniowe,
- \(A\) – powierzchnia zarodka.
Przy założeniu, że zarodek ma kulisty kształt, możliwe jest obliczenie krytycznego promienia zarodka (rk), który wyznacza granicę między zarodkami trwałymi i nietrwałymi:
\[r_k = \frac{2\sigma}{\Delta F_V}\]
Tylko zarodki o promieniu równym lub większym od rk będą stabilne i będą mogły rozrastać się w pełnoprawne kryształy. Zarodki mniejsze niż rk rozpuszczają się z powrotem w cieczy, ponieważ ich istnienie wiązałoby się ze wzrostem energii układu.
Stopień przechłodzenia cieczy ma kluczowy wpływ na wielkość rk. Im większe przechłodzenie, tym większa różnica energii swobodnej pomiędzy cieczą a kryształami i tym mniejszy promień krytyczny. W efekcie powstaje więcej trwałych zarodków, co skutkuje szybszym przebiegiem krystalizacji i drobniejszą strukturą metalu.
Zarodkowanie może być również indukowane przez obecność obcych wtrąceń stałych w cieczy. Cząstki takie (np. tlenki, azotki, pęknięcia w formie) mogą obniżać lokalne napięcie powierzchniowe i ułatwiać heterogeniczne zarodkowanie, nawet przy mniejszym przechłodzeniu.
Równocześnie z zarodkowaniem następuje rozrost kryształów. Proces ten polega na przyłączaniu się kolejnych warstw atomów do powierzchni zarodka. Szczególne znaczenie mają tu dyslokacje śrubowe, których obecność ułatwia wzrost. W miejscach takich tworzy się spiralny uskok, który przyciąga kolejne atomy – prowadząc do ciągłego, efektywnego powiększania się kryształu. Zjawisko to zostało opisane przez F.C. Franka i znane jest jako spirala wzrostu.
Czynniki wpływające na krystalizację
Proces krystalizacji metalu, choć oparty na zasadach termodynamiki i kinetyki, w rzeczywistych warunkach przemysłowych zależy od wielu zmiennych zewnętrznych. Te czynniki wpływają zarówno na liczbę powstających zarodków krystalicznych, jak i na szybkość rozrostu kryształów, co bezpośrednio przekłada się na strukturę końcową zakrzepłego metalu. Do najważniejszych czynników należą:
- Temperatura nagrzania metalu przed odlewaniem oraz czas utrzymywania go w tej temperaturze – im wyższa temperatura i dłuższy czas, tym większe możliwości usunięcia zanieczyszczeń i jednorodniejsze warunki krzepnięcia.
- Temperatura odlewania – wpływa na stopień przechłodzenia, a tym samym na liczbę zarodków i strukturę ziarn.
- Sposób odlewania – techniki takie jak odlewanie grawitacyjne, syfonowe czy kierunkowe mają wpływ na rozkład temperatury w formie, co reguluje przebieg krystalizacji.
- Szybkość chłodzenia – jeden z najważniejszych parametrów; szybkie chłodzenie sprzyja drobnoziarnistej strukturze, podczas gdy wolne chłodzenie prowadzi do gruboziarnistej budowy.
- Rodzaj i temperatura formy odlewniczej – forma wykonana z materiałów dobrze przewodzących ciepło (np. metalowe) oraz chłodna forma przyspieszają odbiór ciepła i zwiększają przechłodzenie cieczy.
- Jakość ciekłego metalu – obecność niemetalicznych wtrąceń (np. tlenków, siarczków) może znacząco wpływać na heterogeniczne zarodkowanie, co z kolei zmienia charakter powstających ziarn.
- Napięcie powierzchniowe metalu w temperaturze krzepnięcia – decyduje o łatwości powstawania powierzchni międzyfazowej pomiędzy cieczą a zarodkiem.
- Wstrząsy mechaniczne, drgania oraz ultradźwięki – mogą zwiększyć liczbę zarodków i przyspieszyć krystalizację, wpływając na strukturę i jednorodność materiału.
Choć teoretycznie znane są zależności między tymi czynnikami a przebiegiem krystalizacji, w praktyce ich wzajemne oddziaływanie jest złożone i trudne do jednoznacznego przewidzenia. Brakuje jednej uniwersalnej teorii, która uwzględniałaby wszystkie zmienne jednocześnie.
Dla uproszczenia opisu procesu krystalizacji, G. Tammann zaproponował dwa parametry:
- Liczbę zarodków krystalicznych powstających spontanicznie w jednostce objętości w ciągu jednej minuty.
- Liniową szybkość krystalizacji, czyli prędkość rozrostu kryształów mierzona w milimetrach na minutę.
Obie wielkości ściśle zależą od stopnia przechłodzenia cieczy. Wraz ze wzrostem przechłodzenia, zarówno liczba zarodków, jak i szybkość krystalizacji początkowo rosną, osiągają maksimum, a następnie maleją. W skrajnych przypadkach, przy bardzo dużym przechłodzeniu, ciecz może zakrzepnąć jako ciało bezpostaciowe (amorficzne).
Szybkość chłodzenia w rzeczywistości jest najczęściej traktowana jako przybliżony odpowiednik stopnia przechłodzenia, co umożliwia jej praktyczne wykorzystanie jako narzędzia do kontroli struktury materiału.

Kształt kryształów i struktura odlewów
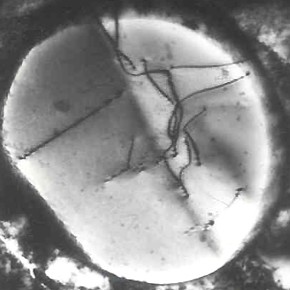
W trakcie krystalizacji z cieczy powstają kryształy o różnych kształtach, zależnych od warunków termicznych i przestrzennych, w jakich przebiega krzepnięcie. Najczęściej występującą formą krystaliczną w metalach są dendryty – rozgałęzione struktury przypominające drzewo, których nazwa pochodzi od greckiego słowa dendron (drzewo).
Kryształy dendrytyczne powstają dlatego, że wzrost kryształów następuje szybciej w kierunku odprowadzania ciepła – najczęściej prostopadle do ścian formy. Początkowo formuje się oś główna dendrytu (pierwszorzędowa), z której pod kątem rozwijają się gałęzie drugorzędowe, a następnie trzeciorzędowe, tworząc charakterystyczną strukturę. W miarę postępu krystalizacji dendryty wydłużają się i grubieją, aż zaczynają się wzajemnie stykać, co zatrzymuje ich dalszy wzrost.
Po zakończeniu wzrostu dendrytów następuje zapełnianie przestrzeni międzydendrytycznych przez resztki ciekłego metalu, który wypełnia puste obszary i również krzepnie. W efekcie dendryty przekształcają się w ziarna krystaliczne, a końcowa struktura metalu składa się z ściśle przylegających do siebie ziarn.
W wyjątkowych przypadkach, kiedy brakuje wystarczającej ilości ciekłego metalu (np. w wyniku skurczu krzepnięcia lub w obecności porowatości), dendryty mogą nie zostać całkowicie wypełnione. Wówczas pozostają widoczne i można je zaobserwować np. w jamach skurczowych. Znane są przypadki odnalezienia olbrzymich dendrytów, np. tzw. Kryształ Czernowa o długości 39 cm, znaleziony w jamie skurczowej 100-tonowego wlewka.
Na podstawie obserwacji krzepnięcia stali w formie można wyróżnić trzy główne strefy krystalizacji w przekroju wlewka:
- Strefa kryształów zamrożonych – cienka warstwa metalu przy ściankach formy, która krzepnie natychmiast, z powodu silnego przechłodzenia. Tworzą ją bardzo drobne, chaotycznie ułożone kryształy.
- Strefa kryształów słupkowych – powstaje w wyniku kierunkowego wzrostu kryształów od ścianek formy w głąb metalu. Kryształy te są wydłużone i ustawione prostopadle do ścian, zgodnie z kierunkiem odprowadzania ciepła.
- Strefa kryształów wolnych – znajduje się w środkowej części wlewka, gdzie brakuje kierunkowego przepływu ciepła. Powstają tam nieliczne, większe i chaotycznie rozmieszczone kryształy, które czasami opadają w cieczy.
Wraz z postępem krystalizacji dochodzi również do zmian składu chemicznego cieczy resztkowej. Pierwsze krystalizujące kryształy są stosunkowo czyste, natomiast domieszki (np. siarka, fosfor, węgiel) koncentrują się w cieczy krzepnącej jako ostatnie, zwykle w górnej części wlewka, w pobliżu jamy skurczowej. To zjawisko nosi nazwę segregacji makroskopowej, w odróżnieniu od mikroskopowej segregacji wewnątrz pojedynczych ziarn.
W zależności od stopnia odtlenienia i odgazowania stali, wyróżnia się różne typy krzepnięcia:
- Stale uspokojone – dobrze odgazowane, krzepną spokojnie, z niewielką ilością pęcherzy gazowych. Charakteryzują się lepszymi właściwościami i mniejszą zawartością zanieczyszczeń.
- Stale nieuspokojone – intensywnie „wrzące” podczas krzepnięcia, z dużą liczbą pęcherzy, których struktura przypomina ser szwajcarski. Ich uzysk jest wyższy, ale właściwości gorsze.
- Stale półuspokojone – pośrednie między powyższymi, uzyskane dzięki częściowemu odtlenieniu np. manganem i aluminium.
Przemiany w stanie stałym
Niektóre metale mogą przyjmować różne struktury krystaliczne w zależności od temperatury i ciśnienia, co prowadzi do zjawiska znanego jako polimorfizm lub inaczej alotropia. Oznacza to, że ten sam pierwiastek może krystalizować w kilku różnych odmianach strukturalnych, które różnią się między sobą typem sieci przestrzennej.
Poszczególne odmiany alotropowe oznacza się greckimi literami: α, β, γ itd., które dodaje się jako indeksy do symbolu chemicznego. Odmiana α jest zazwyczaj trwała w najniższych temperaturach, natomiast kolejne formy pojawiają się wraz ze wzrostem temperatury.
Każda odmiana ma swoje charakterystyczne właściwości fizyczne, chemiczne i mechaniczne. Przejście z jednej struktury w drugą – np. z heksagonalnej do regularnej – jest procesem porównywalnym z krystalizacją z cieczy i nosi nazwę krystalizacji wtórnej. W jej trakcie zachodzą:
- nukleacja (zarodkowanie nowej fazy),
- wzrost nowych kryształów w strukturze już stałej.
Ponieważ przemiany alotropowe zachodzą w środowisku stałym, mogą one zachować częściową orientację krystalograficzną fazy poprzedniej, co ma znaczenie np. przy obróbce cieplnej metali. Przemianom tym często towarzyszą efekty cieplne: wydzielanie ciepła przy chłodzeniu oraz pochłanianie ciepła przy nagrzewaniu.
Na wykresach temperaturowych objawia się to w postaci „przystanków” temperaturowych, podobnych do tych, które obserwuje się przy topnieniu czy krzepnięciu.
Zjawiska alotropowe są ważne technologicznie, ponieważ zmieniają właściwości materiału – np. wytrzymałość, twardość czy rozszerzalność cieplną. Z tego powodu wiele procesów cieplnych (np. hartowanie czy wyżarzanie) wykorzystuje kontrolowane przechodzenie między odmianami alotropowymi.
Przemiany alotropowe wykazują również skłonność do przegrzania lub przechłodzenia, co w praktyce oznacza, że mogą nie wystąpić dokładnie w temperaturze równowagi, ale przy jej lekkim przekroczeniu.
Czym jest krystalizacja metali – podsumowanie
Proces krystalizacji metali jest złożonym zjawiskiem fizykochemicznym, które zależy od wielu czynników – zarówno termodynamicznych, jak i kinetycznych. Kluczowe znaczenie mają tu energia swobodna, stopień przechłodzenia, warunki chłodzenia, a także obecność zarodków krystalicznych i ich zdolność do wzrostu.
Zrozumienie zasad krystalizacji pozwala na kontrolę mikrostruktury metalu, co z kolei przekłada się na jego właściwości mechaniczne, technologiczne i użytkowe. Wiedza ta znajduje zastosowanie m.in. w odlewnictwie, hutnictwie, technologii stopów, spawalnictwie i obróbce cieplnej.
Na przykładzie żelaza widać wyraźnie, jak różne odmiany strukturalne i magnetyczne wpływają na zachowanie materiału w zależności od temperatury. Dlatego też znajomość przebiegu krystalizacji i przemian fazowych stanowi fundament inżynierii materiałowej i jest niezbędna w praktyce przemysłowej.