Biomateriały w medycynie i stomatologii
Spis treści
Biomateriały to kręgosłup współczesnej medycyny rekonstrukcyjnej i stomatologii. Ich zastosowanie zaczyna się od zastawek serca, przez endoprotezy stawów i implanty śródkostne, aż po czujniki, elektrody i systemy dostarczania leków. Celem artykułu jest syntetyczne, ale rozwinięte przedstawienie ich definicji, wymagań biokompatybilności, głównych klas, mechanizmów interakcji z organizmem, zasad testowania i degradacji, a także zwrócenie uwagi na kluczowe aspekty inżynierii powierzchni oraz produkcji precyzyjnej, które decydują o sukcesie klinicznym wyrobu. Artykuł oparto na klasycznej monografii „Biomaterials Science: An Introduction to Materials in Medicine”, red. B.D. Ratner i in. (Academic Press).
Biomateriały należy analizować zawsze w kontekście ich zastosowania klinicznego, w skonkretyzowanym środowisku biologicznym i po rzeczywistych procesach wytwarzania oraz sterylizacji, ponieważ te etapy definiują ich właściwości funkcjonalne i bezpieczeństwo.

Czym jest biomateriał i czym jest biokompatybilność?
W ujęciu przyjętym w literaturze, biomateriał to materiał nieożywiony, przeznaczony do oddziaływania z układem biologicznym w urządzeniu medycznym. Jego akceptowalność kliniczna zależy od biokompatybilności, czyli zdolności do wywołania odpowiedniej, celowo pożądanej reakcji gospodarza w danym zastosowaniu, a więc takiej, która umożliwia zamierzony efekt terapeutyczny i nie generuje nieakceptowalnego ryzyka. Te definicje, ugruntowane m.in. w pracach D.F. Williamsa i w rozdziałach wprowadzających monografii, stały się klamrą spinającą interdyscyplinarny rozwój dziedziny.
Biokompatybilność jest relacją materiał–urządzenie–pacjent–zastosowanie; identyczny materiał może być biokompatybilny w jednym wyrobie, a problematyczny w innym.
Historycznie biomateriały obejmowały zarówno metale stosowane w protetyce (np. złoto w stomatologii), jak i szkła czy drewno w protezach zewnętrznych. Dzisiejsze rozumienie dyscypliny wykształciło się wraz z krystalizacją środowiska naukowego, sympozjami i powstaniem towarzystw naukowych; równolegle ukształtowała się struktura literatury fachowej i standardów.
Systematyka materiałów używanych w medycynie i stomatologii obejmuje: metale, polimery, hydrożele, materiały bioresorbowalne, ceramiki i szkło-ceramiki, materiały naturalne, kompozyty, a także cienkie warstwy, powłoki i przeszczepy powierzchniowe, tekstylia oraz materiały funkcjonalne (aktywnie reagujące na bodźce). Podręcznikowo zestawia to część I monografii, a szczegółowe rozdziały omawiają charakterystykę, własności i aplikacje poszczególnych klas.
W praktyce klinicznej materiał rzadko występuje samodzielnie, tworzy wyrób medyczny o określonej geometrii, chropowatości, czystości i historii przetwarzania; przykładowo rozdziały części II i VII opisują implanty naczyniowe, elektrody, czujniki, implanty stomatologiczne, ortopedyczne oraz systemy dostarczania leków.
Metale (np. stale Cr–Ni–Mo, stopy Co–Cr, stopy tytanu) pozostają podstawą implantów obciążanych mechanicznie (płytki, śruby, endoprotezy, elementy zastawek). Właściwości mechaniczne, trwałość zmęczeniowa i odporność korozyjna są tu pierwszoplanowe, a ich poziom silnie zależy od historii przetwarzania (od wytopu, przez obróbkę plastyczną, do obróbki cieplnej) i od mikrostruktury.
Polimery (od termoplastów po elastomery i sieciowane żywice) zapewniają elastyczność, niską gęstość, łatwość formowania oraz możliwość modyfikowania mikrostruktury i funkcji (np. powłoki hemokompatybilne, przewodzące żele, membrany). Rozdziały o polimerach podkreślają znaczenie molekularnej masy (Mn, Mw), polidyspersyjności oraz taktyczności dla własności mechanicznych i przetwórczych; z punktu widzenia eksploatacji krytyczne są przejście szkliste (Tg), topnienie frakcji krystalicznej (Tm) i plateau gumowe widoczne w badaniach DMA.
Ceramiki i szkło-ceramiki, od tlenkowych (alumina, cyrkonia) po bioaktywne szkła, są kluczowe tam, gdzie wymagane są wysoka twardość, chemiczna stabilność i bioaktywność np. w stomatologii odtwórczej i naprawie ubytków kostnych. Te materiały mogą tworzyć silną, chemicznie pośredniczoną więź z tkanką (bioaktywność), co szeroko omówiono w klasie „bioceramics”.
Materiały naturalne (kolagen, elastyna, polisacharydy) zyskują na znaczeniu w inżynierii tkankowej dzięki podobieństwu do macierzy pozakomórkowej i potencjale prowadzenia regeneracji (np. rusztowania skóry czy nerwów).
Dobór materiału jest sprzężony z miejscem anatomicznym i reżimem obciążeń: zastawki serca wymagają odporności na zmęczenie i krzepnięcie krwi; endoprotezy biodra — wysokiej wytrzymałości i odpowiednich par trących; implanty stomatologiczne — biointegracji i szczelności biologicznej przejścia przez tkankę miękką. Program rozdziałów VII dokładnie opisuje te wymagania na konkretne typy wyrobów.
Właściwości objętościowe i powierzchniowe
W biomateriałach odróżniamy właściwości objętościowe (wytrzymałość, moduł, udarność, pełzanie, zmęczenie, przewodnictwo) i właściwości powierzchniowe (energia i chemia powierzchni, ładunek, topografia, warstwa graniczna po adsorpcji białek). Te drugie determinują pierwszy kontakt z krwią i tkankami — kaskadę adsorpcji protein, aktywację komórek i kaskadę krzepnięcia. W monografii zebrano rozdziały poświęcone adsorpcji białek i odpowiedzi krwi na materiał, a także korelacjom własności powierzchniowych z odpowiedzią biologiczną.
W polimerach architektura makrocząsteczek (liniowa, rozgałęziona, sieciowana), krystaliczność, taktyczność i rozkład mas cząsteczkowych determinują odpowiedź mechaniczno-termiczną; w ujęciu inżynierskim krytyczne są parametry sterujące przetwórstwem (np. wtrysk, wytłaczanie, formowanie reaktywne) i zachowaniem podczas cyklu życia wyrobu. Rozkłady Mn/Mw, Tg i Tm oraz widma DMA to baza do projektowania struktur membran, powłok i elastomerów implantacyjnych.
Nawet subtelne różnice powierzchni (chemia, nanotekstura, historia sterylizacji) mogą radykalnie zmienić profil adsorpcji białek, a dalej trombogenność i gojenie, dlatego zarządzanie stanem powierzchni jest równorzędne wobec doboru składu chemicznego materiału.
Jak organizm odpowiada na biomateriał?
Po implantacji uruchamia się łańcuch reakcji gospodarza: hemostaza, zapalenie ostre, proliferacja i przebudowa tkanek. W obecności ciała obcego rozwija się reakcja na ciało obce, przewlekła aktywacja makrofagów, tworzenie komórek olbrzymich typu ciała obcego i włóknistej torebki. Odrębne, złożone procesy dotyczą kontaktu z krwią (aktywacja płytek, kaskada krzepnięcia) oraz układu odpornościowego (immunologia i dopełniacz). Kompendium rozdziałów 4.1–4.7 dostarcza struktury pojęciowej i metod oceny tej odpowiedzi.
Wzorzec odpowiedzi zależy od miejsca implantacji, wielkości i chropowatości, składu materiałowego i stanu powierzchni; nawet to samo tworzywo może indukować inny fenotyp makrofagów w tkance miękkiej i przykostnie. Dlatego ocena zgodności biologicznej musi być zastosowanie-specyficzna (in vitro + in vivo).
Testowanie biomateriałów obejmuje badania in vitro (komórki, białka, hemokompatybilność), badania in vivo (modele zwierzęce i miejsca implantacji), testy krwi–materiał i projektowanie modeli zwierzęcych adekwatnie do wskazania klinicznego. Zebrane w rozdz. 5.1–5.5 wytyczne tworzą wspólny język dla laboratoriów akademickich i przemysłowych oraz dla oceny regulacyjnej. Wyniki z jednego poziomu (np. in vitro) nie mogą być bezpośrednio ekstrapolowane na wynik kliniczny, triangulacja danych (in vitro–in vivo–analiza eksplantów) jest złotym standardem w rozwoju i nadzorze wyrobów.
Degradacja i starzenie w środowisku biologicznym
Organizm nie jest prostym środowiskiem do zaprojektowania materiału. Jest on bogaty w białka, enzymy i komórki zdolne generować reaktywne formy tlenu i chloru. W tych realiach materiały podlegają hydrolizie, utlenianiu, korozji, zmęczeniu, pękaniu naprężeniowemu, a nawet patologicznej mineralizacji. Rozdziały 6.1–6.5 stanowią przekrojowy przegląd mechanizmów degradacji polimerów, metali i ceramik.
Szczególnie pouczający jest mechanizm utleniania polimerów przez gospodarza. W ostrym zapaleniu neutrofile wytwarzają anion ponadtlenkowy, nadtlenek wodoru i (z udziałem mieloperoksydazy) kwas podchlorawy (HOCl); makrofagi, które dominują przewlekle (wraz z komórkami olbrzymimi), podtrzymują emisję wolnych rodników, a adhezja MPO do powierzchni ciała obcego może podawać katalizator w miejscu implantacji. To środowisko sprzyja utlenianiu wiązań eterowych i uretydowych, inicjacji pęknięć i pękaniu naprężeniowemu w elastomerach uretanowych, zjawiska obserwowano m.in. w poliuretanowych komponentach elektrod i przewodów rozruszników.
Degradacja jest synergistyczna: naprzemienne obciążenia wytwarzają mikropęknięcia i świeżą powierzchnię reaktywną; absorpcja wody zmienia lokalne pH i dyfuzję reagentów; produkty hydrolizy zwiększają hydrofilowość i penetrację czynników degradacyjnych. Sterowanie składem, stabilizacją antyoksydacyjną i stanem naprężeń resztkowych jest kluczowe dla bezpieczeństwa długoterminowego.
W metalach korozyjnych degradacja obejmuje m.in. korozję wżerową i szczelinową, korozję naprężeniową oraz zużycie tribologiczne w parach trących, które może prowadzić do luźnych cząstek i reakcji tkankowych. Ceramiki, choć chemicznie stabilniejsze, są kruche i wrażliwe na defekty inicjujące pękanie; ich projekt wymaga rygorystycznej kontroli wad.
Przykłady zastosowań klinicznych
Układ sercowo-naczyniowy. Materiały dla zastawek, graftów, stentów, układów pozautrzałkowych i sztucznych narządów muszą godzić hemokompatybilność z trwałością mechaniczną i odpornością na osadzanie się białek/komórek. Strategie nietrombogenne obejmują modyfikacje powierzchni (heparynizacja, hydrożele) i kontrolę energii powierzchni.
Stomatologia – Implanty tytanowe i cyrkonowe rewolucjonizowały rehabilitację protetyczną; powodzenie zależy od biointegracji z kością (ściślej, czyli bliskiej adhezji i mechanicznej retencji) oraz od szczelności przejścia przez błonę śluzową. Materiały dla uzupełnień (ceramiki szlachetne, szkło-ceramiki) czerpią z postępów w bioceramice i obróbce precyzyjnej.
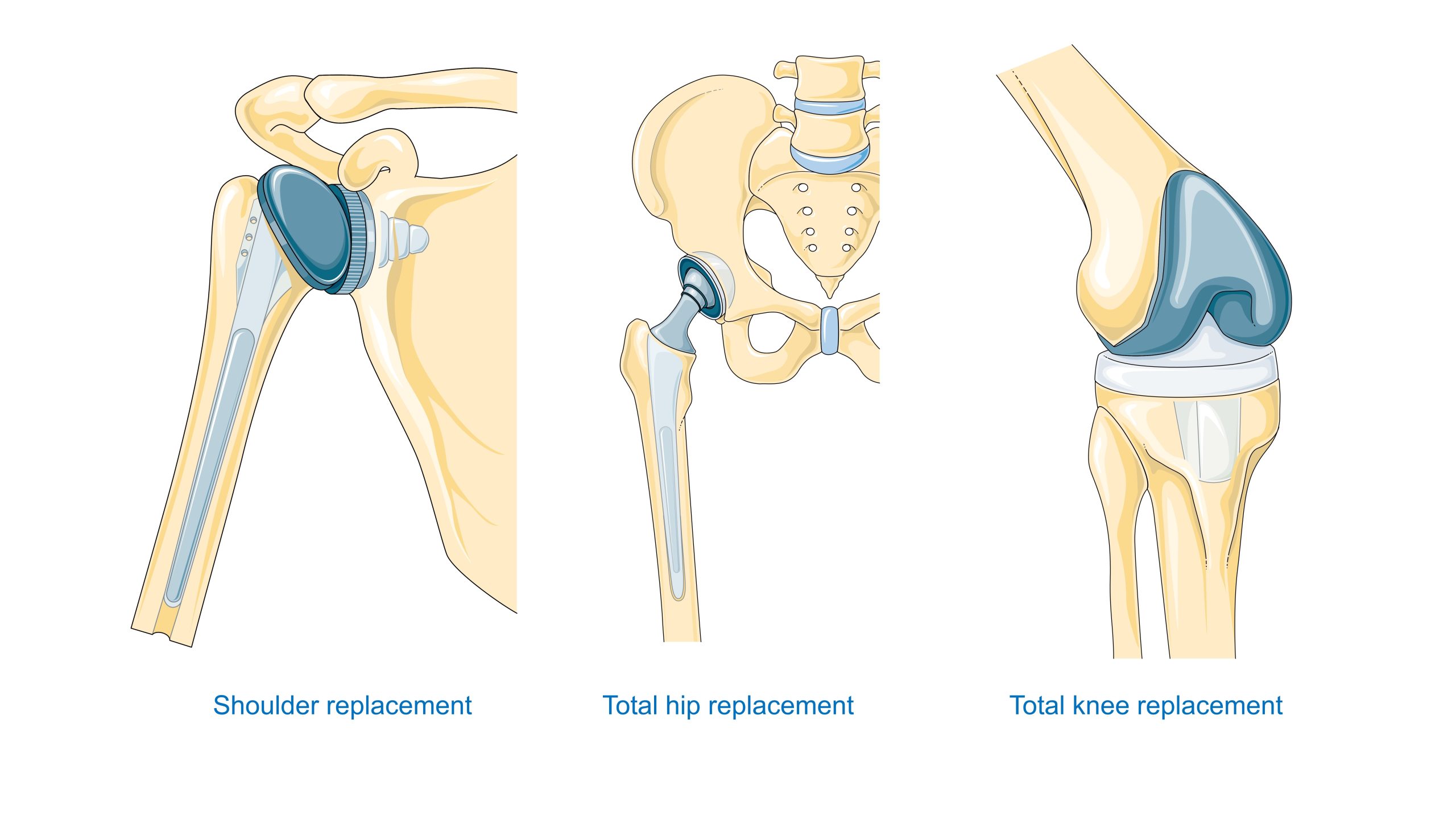
Ortopedia – Endoprotezy biodra i kolana wymagają kompromisu pomiędzy wytrzymałością statyczną i zmęczeniową, odpornością zużyciową i właściwościami trybologicznymi pary trącej (metal–polietylen UHMWPE, ceramika–ceramika, metal–metal). Dodatkowo znaczenie ma łączenie z kością: cement akrylowy vs. porowate powłoki dla osteointegracji.
Produkcja precyzyjna, mikrostruktura i inżynieria powierzchni
W przypadku implantów metalowych, własności wynikają z całego łańcucha przetwarzania: od wytopu i rafinacji, przez odkształcanie plastyczne i obróbkę cieplną, po obróbkę skrawaniem, spawanie, nakładanie powłok i sterylizację. Mikrostruktura (rozmiar ziarna, fazy, tekstura) oraz defekty pochodzące z procesów wpływają na wytrzymałość zmęczeniową i odporność korozyjną. Wprowadzenie porowatych powłok i struktur (np. spiekane siatki, natryski plazmowe) to przykład zadania interdyscyplinarnego: trzeba wyważyć przyczepność, sztywność, topografię i integralność zmęczeniową całego komponentu.
W polimerach równorzędnie ważne są parametry przetwórstwa (temperatura, czas, naprężenia resztkowe), a także dobór stabilizatorów antyoksydacyjnych i kontrola czystości — bo to one warunkują późniejszą biostabilność. W praktyce opisano przypadki pękania naprężeniowego poliuretanów w przewodach rozruszników właśnie na styku naprężeń resztkowych, środowiska biologicznego i utleniania przez gospodarza.
Inżynieria powierzchni to zestaw narzędzi do modyfikowania właściwości: od fizykochemicznych powłok, przez nanoszenie cienkich filmów i szczepionych warstw polimerowych, po topografie mikro/nano. Korelacje między parametrami powierzchni a odpowiedzią biologiczną są przedmiotem dedykowanych rozdziałów praktycznych.
Dla wyrobów długoimplantowanych małe decyzje procesowe (np. rodzaj sterylizacji, warunki starzenia magazynowego) mogą stać się dużymi przyczynami różnic klinicznych po latach, dokumentowanie historii przetwarzania i kontrola jakości są integralną częścią projektowania biomateriału.
Etyka, regulacje i standardy
Wprowadzanie wyrobów na rynek odbywa się w ramach rygorystycznych systemów oceny, w tym FDA i ISO. Koszt pokazania bezpieczeństwa i skuteczności jest znaczny, ale chroni pacjentów i kształtuje politykę jakości. Równocześnie pojawiają się pytania etyczne: jak równoważyć interes pacjenta i presję ekonomiczną, jak projektować badania z minimalizacją ryzyka, kiedy i jak wycofywać przestarzałe rozwiązania. Te zagadnienia, wraz z rolą norm konsensusu i rozwojem technologii, omawia część poświęcona nowym produktom i standardom. Postęp kliniczny wymaga równoczesnego postępu w metodologii oceny, standardach i etyce; inaczej innowacja może być pozorna albo ryzykowna.
Perspektywy
Na horyzoncie znajdują się materiały biologicznie funkcjonalne (reagujące na bodźce), oraz rozwinięte systemy biosensorów i narządów sztucznych (implantowalnych i pozaustrojowych), które czynią z interfejsu bio–materiał centrum informatyki fizjologicznej. Ich sukces zależeć będzie od subtelnej kontroli interakcji powierzchniowych, stabilności długoterminowej i zabezpieczenia przed degradacją. Część monografii poświęcona narządom sztucznym i biosensorom pokazuje, jak ściśle materiały, elektronika i biologia muszą współgrać. Przyszłość biomateriałów to systemy hybrydowe, które będą wymagały jeszcze bardziej drobiazgowej kontroli mikrostruktury i powierzchni.
Biomateriały w medycynie i stomatologii – podsumowanie
Biomateriały są aktywnymi komponentami terapii, które współtworzą mikrośrodowisko biologiczne. O sukcesie decydują równorzędnie: dobór klasy materiału, inżynieria powierzchni, mikrostruktura i historia przetwarzania, a także rozumienie reakcji gospodarza oraz mechanizmów degradacji w czasie. Metale, polimery i ceramiki wnoszą odmienne zestawy zalet i ryzyk; naturalne polimery i systemy bioaktywne rozszerzają paletę o funkcje regeneracyjne. Z klinicznego punktu widzenia każdy projekt to problem wieloobiektowej optymalizacji pod konkretne wskazanie i populację pacjentów, co monografia systematyzuje, prowadząc od definicji i właściwości, przez biologię kontaktu i testowanie, po praktyczne aspekty implantacji i analizę eksplantów. Wreszcie, produkcja precyzyjna i kontrola jakości to nie ostatni etap, lecz integralna część nauki o biomateriałach, ponieważ to one dyktują w materiale jego długoterminowe zachowanie w ciele.
Nadrzędną kompetencją w projektowaniu biomateriałów jest umiejętność łączenia nauki o materiałach z biologią i inżynierią wyrobu — od chemii i mikrostruktury, przez powierzchnię, po wytwarzanie i sterylizację. W ten sposób powstaje jedno, dobrze udokumentowane rozwiązanie kliniczne, zweryfikowane na ścieżce in vitro–in vivo–klinika.
Bibliografia
Ratner, B.D., Hoffman, A.S., Schoen, F.J., Lemons, J.E. (red.). Biomaterials Science: An Introduction to Materials in Medicine. Academic Press, San Diego–London–Boston–New York–Sydney–Tokyo–Toronto, 1996.