Les biomatériaux en médecine et en dentisterie
Table des matières
Les biomatériaux constituent la base de la médecine reconstructive et de la dentisterie modernes. Leurs applications s’étendent des valves cardiaques et des endoprothèses articulaires, des implants intra-osseux, capteurs, électrodes et des systèmes d’administration de médicaments. Cet article vise à fournir un aperçu concis, mais complet, de leur définition, des exigences en matière de biocompatibilité, des principales catégories, des mécanismes d’interaction avec le corps, des tests et des principes de dégradation, ainsi qu’à mettre en évidence les aspects clés de l’ingénierie des surfaces et de la fabrication de précision qui déterminent le succès clinique d’un produit. Cet article s’appuie sur la monographie classique « Biomaterials Science: An Introduction to Materials in Medicine », éditée par B.D. Ratner et al. – 2004 – Elsevier Academic Press.
Les biomatériaux doivent toujours être analysés dans le contexte de leur application clinique, dans un environnement biologique spécifique et après avoir subi les processus réels de fabrication et de stérilisation, car toutes ces étapes définissent leurs propriétés fonctionnelles et leur sécurité.

Qu’est-ce qu’un biomatériau et qu’est-ce que la biocompatibilité ?
Dans la terminologie adoptée dans la littérature, un biomatériau est un matériau inanimé, destiné à interagir avec un système biologique, dans un dispositif médical. Son acceptabilité clinique dépend de sa biocompatibilité, c’est-à-dire de sa capacité à susciter une réponse appropriée et délibérément souhaitée de l’hôte dans une application donnée, c’est-à-dire une réponse qui permet d’obtenir l’effet thérapeutique escompté et qui ne génère pas de risque inacceptable. Ces définitions, établies dans les travaux de D.F. Williams, de l’Université de Liverpool et dans les chapitres introductifs de monographies, entre autres, sont devenues les fondations du développement interdisciplinaire de ce domaine.
La biocompatibilité est une relation matériau-dispositif-patient-application, alors qu’un même matériau peut être biocompatible dans un produit/environnement et problématique dans un autre.
Historiquement, les biomatériaux comprenaient à la fois les métaux utilisés dans les prothèses, par exemple, l’or en dentisterie, et les matériaux tels que le verre ou le bois dans les prothèses externes. La compréhension actuelle de cette discipline s’est développée parallèlement à la cristallisation de la communauté scientifique, grâce aux symposiums et à la création de sociétés scientifiques. Dans le même temps, la structure de la littérature professionnelle et des normes a pris corps et forme.
Les matériaux utilisés en médecine et en dentisterie incluent donc systématiquement les métaux, les polymères, les hydrogels, les matériaux biorésorbables, les céramiques et vitrocéramiques, les matériaux naturels, les composites, ainsi que les couches minces, les revêtements et les greffes de surface. Viennent aussi les textiles et les matériaux fonctionnels qui réagissent activement aux stimuli. Ces informations sont résumées dans la première partie de ce texte, tandis que des chapitres détaillés traitent des caractéristiques, des propriétés et des applications de chacune des catégories, dans la partie suivante.
Dans la pratique clinique, un matériau est rarement utilisé seul, mais forme un dispositif médical disposant d’une géométrie, d’une rugosité, d’une pureté et d’un historique de traitement spécifiques. Pour apporter des exemples, nous parlerons des applications d’éléments tels que les implants vasculaires, les électrodes, les capteurs, les implants dentaires et orthopédiques ainsi que des systèmes d’administration de médicaments.
Les matériaux
Les métaux, notamment les aciers Cr-Ni-Mo, les alliages Co-Cr, les alliages de titane, restent la base des implants soumis à des contraintes mécaniques, telles que plaques, vis, endoprothèses et composants de valves. Les propriétés mécaniques, la résistance à la fatigue, autant que celles à la corrosion sont primordiales et leur niveau dépend fortement de l’historique de traitement, en particulier la fusion au travail plastique en passant par le traitement thermique et de la microstructure.
Les polymères, qui sont des thermoplastiques aux élastomères et aux résines réticulées, offrent une grande flexibilité, une faible densité, une facilité de mise en forme et la possibilité de modifier la microstructure et la fonction. Pour citer un exemple, les revêtements hémocompatibles, les gels conducteurs et les membranes. Les textes consacrés aux polymères soulignent tous l’importance de leur poids moléculaire (Mn, Mw), de leur polydispersité et de leur tacticité, pour les propriétés mécaniques et de transformation. D’un point de vue opérationnel, la transition vitreuse (Tg), la fusion cristalline (Tm) et le plateau caoutchouteux, visibles dans les tests DMA, sont aussi essentiels.
Les céramiques et les vitrocéramiques, qui vont des oxydes, tels que l’alumine et la zircone, dont les verres sont bioactifs, sont indispensables dans les applications pour lesquelles une dureté élevée, une stabilité chimique et une bioactivité sont requises, par exemple en dentisterie restauratrice et dans la réparation de défauts osseux. Ces matériaux peuvent former une liaison solide, chimiquement médiée, avec les tissus et leur bioactivité, ce qui est dénommé « biocéramiques ».
Les matériaux naturels, ainsi le collagène, l’élastine, les polysaccharides, prennent de plus en plus d’importance dans l’ingénierie tissulaire, en raison de leur similitude avec la matrice extracellulaire et de leur potentiel à favoriser la régénération. Nous pensons ici aux échafaudages biomimétiques cutanés ou bien nerveux.
Le choix du matériau est donc directement lié à la localisation anatomique et au régime de contraintes. Les valves cardiaques doivent résister à la fatigue et à la coagulation sanguine, tandis que les endoprothèses de hanche doivent présenter une résistance élevée et des couples de frottement appropriés. Et pour finir, les implants dentaires doivent permettre la bio-intégration et l’étanchéité biologique du passage des tissus mous, aux exigences si spécifiques.
Propriétés volumiques et superficielles
Dans les biomatériaux, nous distinguons les propriétés volumiques, c’est-à-dire résistance, module, résistance aux chocs, fluage, fatigue et conductivité, des propriétés superficielles, énergie et chimie de surface, charge, topographie et couche limite après adsorption des protéines. Ces dernières déterminent le premier contact avec le sang et les tissus, constituée de la cascade d’adsorption des protéines, de l’activation cellulaire et de la cascade de coagulation. Ces éléments, tels que l’adsorption des protéines et à la réponse du sang au matériau, ainsi que les corrélations entre les propriétés de surface et la réponse biologique sont donc étroitement surveillés.
Dans les polymères, l’architecture des macromolécules, qu’elles soient linéaires, ramifiées ou réticulées, la cristallinité, la tacticité et la distribution du poids moléculaire déterminent les réponses mécaniques et thermiques. D’un point de vue purement technique, les paramètres contrôlant le traitement, par exemple, l’injection, l’extrusion ou le moulage réactif, et le comportement pendant le cycle de vie du produit sont primordiaux. Les distributions Mn/Mw, Tg et Tm, ainsi que les spectres DMA, servent de base à la conception des structures membranaires, des revêtements et des élastomères qui peuvent être implantés.
Même de subtiles différences dans les propriétés de surface, au plan chimie, nanotexture, historique de stérilisation, peuvent modifier radicalement le profil d’adsorption des protéines et, par conséquent, affecter la thrombogénicité et la cicatrisation. C’est pourquoi la gestion de l’état de surface est aussi importante que le choix de la composition chimique du matériau en lui-même.
Comment le corps réagit-il aux biomatériaux ?
Après l’implantation, une chaîne de réactions de l’hôte se déclenche, notamment l’hémostase, l’inflammation aiguë, la prolifération et le remodelage tissulaire en présence d’un corps étranger. Il en résulte une réaction au corps étranger, caractérisée par l’activation chronique des macrophages, la formation de cellules géantes étrangères et le développement d’une capsule fibreuse. Ces processus distincts et complexes impliquent le contact avec le sang, par l’activation des plaquettes et la cascade de coagulation, du système immunitaire, de l’immunologie et du système du complément. Le recueil des chapitres 4.1 à 4.7 fournit un cadre conceptuel et des méthodes pour évaluer cette réponse.
Le modèle de réponse dépend du site d’implantation, de la taille et de la rugosité, ainsi que de la composition du matériau et de l’état de sa surface. Même un matériau similaire peut induire différents phénotypes de macrophages dans les tissus mous et les tissus périostés. Par conséquent, l’évaluation de la biocompatibilité doit être spécifique à l’application (in vitro + in vivo).
Par ailleurs, les essais sur les biomatériaux comprennent des études in vitro, notamment cellules, protéines et hémocompatibilité, bien évidemment des études in vivo, modèles animaux et sites d’implantation, des essais sang-matériau et la conception de modèles animaux adaptés à l’indication clinique. Les lignes directrices principales permettent d’établir un langage commun pour les laboratoires universitaires et industriels, ainsi que pour l’évaluation réglementaire. Les résultats d’un niveau, par exemple, in vitro, ne peuvent pas être directement extrapolés aux résultats cliniques. La triangulation des données prend alors toute sa dimension, analyse in vitro-in vivo-explant, devenant la norme de référence en matière de développement et de surveillance des produits.
Dégradation et vieillissement dans un environnement biologique
Le corps ne constitue pas un environnement simple, dans le cadre de la conception de matériaux. Il est riche en protéines, en enzymes et contient des cellules capables de générer des espèces réactives de l’oxygène et du chlore. Dans un tel environnement, les matériaux sont soumis à l’hydrolyse, à l’oxydation, à la corrosion, à la fatigue, à la fissuration sous contrainte et même à la minéralisation pathologique. Les mécanismes de dégradation des polymères, des métaux et des céramiques sont donc nécessairement étudiés.
Le mécanisme par lequel le polymère hôte s’oxyde est particulièrement instructif. Dans le cas d’une inflammation aiguë, les neutrophiles produisent des anions superoxydes, du peroxyde d’hydrogène et, grâce à la participation de la myéloperoxydase de l’acide hypochloreux (HOCl). D’autre part, les macrophages, qui dominent dans les cas chroniques, avec les cellules géantes, maintiennent l’émission de radicaux libres, et l’adhésion de la MPO à la surface du corps étranger peut agir comme catalyseur au site d’implantation. Cet environnement favorise l’oxydation des liaisons éther et uréthane, ainsi que l’apparition de fissures ainsi que de fissures sous contrainte dans les élastomères uréthane, phénomènes observés, entre autres, dans les composants en polyuréthane des électrodes et des sondes de stimulateurs cardiaques.
La dégradation est synergique, à savoir, les charges alternées produisent des microfissures et une surface réactive nouvelle. L’absorption d’eau modifie le pH local et facilite la diffusion des réactifs. En outre, les produits d’hydrolyse renforcent l’hydrophilie et la pénétration des agents de dégradation. Le contrôle de la composition, la stabilisation antioxydante et les conditions de contrainte résiduelle sont éveidemment essentiels pour la sécurité à long terme.
Dans les métaux corrosifs, la dégradation comprend la corrosion par piqûres et par crevasses, la corrosion sous contrainte et l’usure tribologique dans les paires de frottement, ce qui peut entraîner des particules libres et des réactions tissulaires. Les céramiques, bien que chimiquement plus stables, sont fragiles et sensibles aux défauts provoquant des fissures. Il va sans dire que leur conception nécessite un contrôle rigoureux des défauts.
Exemples d’applications cliniques
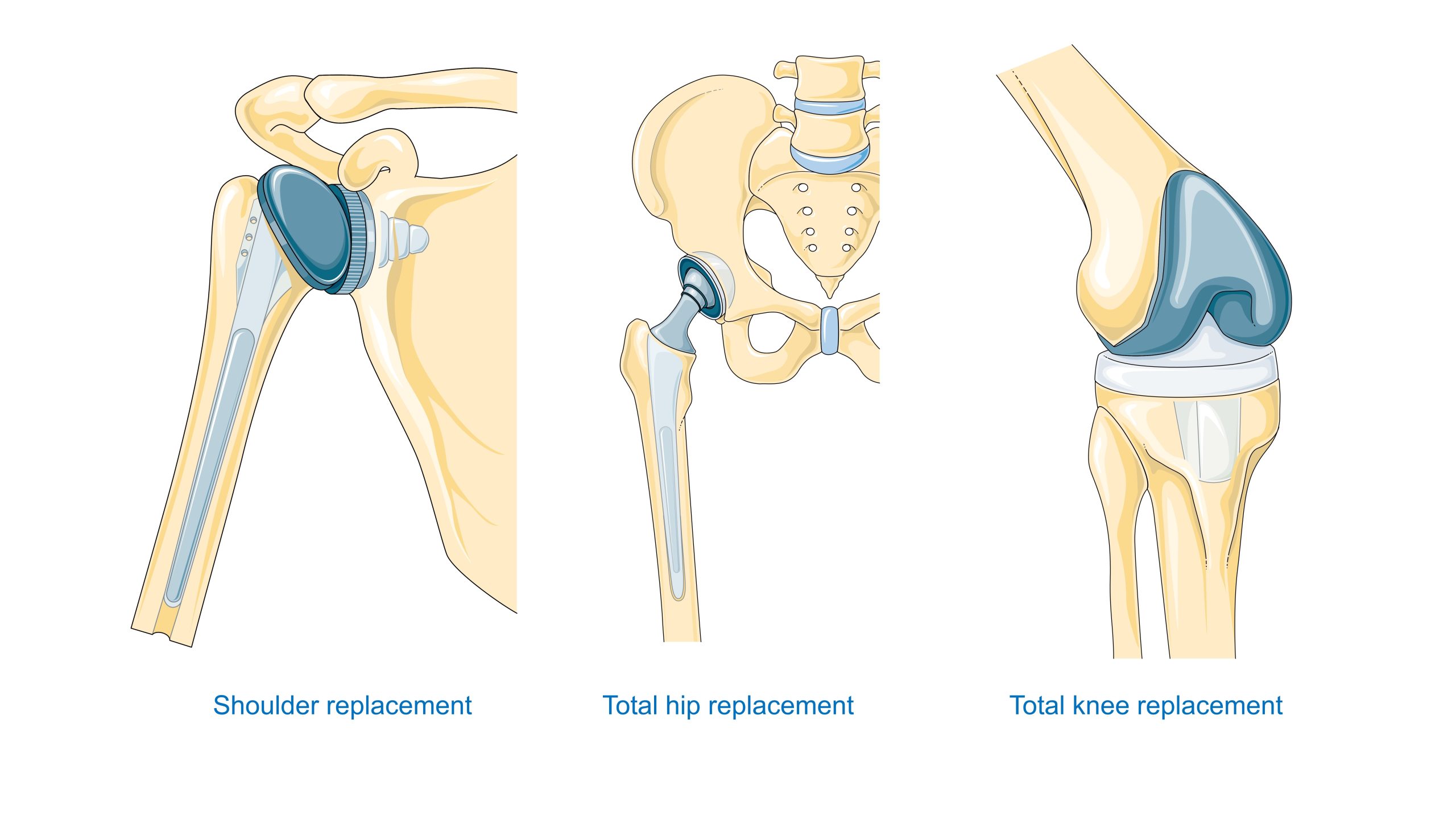
Système cardiovasculaire. Les matériaux utilisés pour les valves, les greffons, les stents, les systèmes extracorporels et les organes artificiels doivent trouver un équilibre entre l’hémocompatibilité et la durabilité mécanique, ainsi que la résistance aux dépôts de protéines et cellules. Les stratégies non thrombogènes comprennent les modifications de surface, telles que l’héparinisation et les hydrogels, et le contrôle de l’énergie de surface.
Dentisterie – Les implants en titane et en zirconium ont révolutionné la réhabilitation prothétique. Leur succès dépend de la bio-intégration avec l’os (plus précisément, d’une adhérence étroite et d’une rétention mécanique) et de l’étanchéité du passage à travers la muqueuse. Les matériaux utilisés pour les restaurations, telles que céramiques précieuses et vitrocéramiques, bénéficient largement des progrès réalisés dans le domaine des biocéramiques et de l’usinage de précision.
Orthopédie – Les endoprothèses de hanche et de genou nécessitent un compromis entre la résistance statique et la résistance à la fatigue, la résistance à l’usure et les propriétés tribologiques du couple de frottement, pour des implants métal-polyéthylène UHMWPE, céramique-céramique ou métal-métal. De plus, la connexion avec l’os est cruciale, pour laquelle la comparaison entre le ciment acrylique et les revêtements poreux pour l’ostéointégration s’impose.
Fabrication de précision, microstructure et ingénierie des surfaces
Dans le cas des implants métalliques, les propriétés résultent de l’ensemble de la chaîne de traitement, depuis la fusion et l’affinage jusqu’à l’usinage, le soudage, le revêtement et la stérilisation, en passant par la déformation plastique et le traitement thermique. La microstructure, comprenant taille des grains, phases et texture, et les défauts induits par le processus influencent la résistance à la fatigue et la résistance à la corrosion. L’introduction de revêtements et de structures poreuses, par exemple les mailles frittées, les projections au plasma, sont des exemples parfaits de tâches interdisciplinaires. L’adhérence, la rigidité, la topographie et l’intégrité à la fatigue de l’ensemble du composant doivent être équilibrées parfaitement.
Dans les polymères, les paramètres de traitement, température, temps et contraintes résiduelles, sont tout aussi importants que le choix des stabilisateurs antioxydants et le contrôle de la pureté, car ces facteurs déterminent la biostabilité ultérieure. Dans la pratique, des cas de fissuration sous contrainte ont déjà été observés dans les polyuréthanes utilisés dans les sondes de pacemaker, en particulier à l’interface entre les contraintes résiduelles, l’environnement biologique et l’oxydation par l’hôte.
L’ingénierie des surfaces est un ensemble d’outils permettant de modifier les propriétés, allant des revêtements physico-chimiques à l’application de films minces et de couches de polymères greffés, en passant par la micro ou la nano topographie, marquant les étroites corrélations entre les paramètres de surface et la réponse biologique.
Pour les dispositifs implantés à long terme, des décisions moindres, relatives au processus, par exemple, le type de stérilisation, les conditions de vieillissement pendant le stockage, peuvent toutefois devenir des causes majeures de différences cliniques des années plus tard. La documentation de l’historique du traitement et le contrôle de la qualité font donc partie intégrante de la conception des biomatériaux.
Éthique, réglementations et normes
Bien évidemment, les produits sont mis sur le marché après avoir été soumis à des systèmes d’évaluation rigoureux, notamment ceux de la FDA et de l’ISO. Le coût de la démonstration de la sécurité et de l’efficacité est important, mais ceci protège les patients et façonne la politique de qualité. Dans le même temps, de nouvelles questions éthiques se posent… En effet, comment équilibrer les intérêts des patients et les pressions économiques ? Comment concevoir des études avec un risque minimal, quand et comment retirer les solutions obsolètes ? Toutes ces questions, ainsi que le rôle des normes consensuelles et du développement technologique, sont génératrices de nouvelles normes. Les progrès cliniques nécessitent des progrès simultanés en matière de méthodologie d’évaluation, de normes et d’éthique, sans quoi l’innovation peut se révéler totalement illusoire ou risquée.
Perspectives
À l’horizon se profilent des matériaux biologiquement fonctionnels, qui sont réactifs aux stimuli et des systèmes avancés de biocapteurs ou bien d’organes artificiels, qu’ils soient implantés et extracorporels, qui placent l’interface biomédicale au centre de l’informatique physiologique. Leur succès dépendra d’un contrôle subtil des interactions de surface, d’une stabilité à long terme et d’une protection contre la dégradation. Les publications consacrées aux organes artificiels et aux biocapteurs montre à quel point les matériaux, l’électronique et la biologie doivent travailler en étroite collaboration. L’avenir des biomatériaux réside dans les systèmes hybrides, qui nécessiteront un contrôle encore plus méticuleux de la microstructure et de la surface.
Les biomatériaux en médecine et en dentisterie – Résumé
Les biomatériaux sont des composants actifs de la thérapie qui co-créent le microenvironnement biologique. Le succès est déterminé, à parts égales, par le choix de la classe de matériaux, l’ingénierie de surface, la microstructure et l’historique de traitement, ainsi que par la compréhension de la réponse de l’hôte et des mécanismes de dégradation au fil du temps. Les métaux, les polymères et les céramiques présentent différents avantages autant que des risques. En effet, les polymères naturels et les systèmes bioactifs élargissent la palette avec des fonctions régénératives. D’un point de vue clinique, chaque projet présente un problème d’optimisation multi-objectifs, pour une indication et une population de patients spécifiques, que la monographie systématise. Tout ceci passe par des définitions et par des propriétés étudiées de près, par la biologie de contact et par les tests, pour aller jusqu’aux aspects pratiques de l’implantation et de l’analyse des explants.
Enfin, la fabrication de précision et le contrôle qualité ne constituent assurément pas la dernière étape, mais font partie intégrante de la science des biomatériaux, car ils déterminent le comportement, à long terme, du matériau dans l’organisme.
La compétence globale, en matière de conception de biomatériaux, est donc à trouver dans la capacité à combiner la science des matériaux avec la biologie et l’ingénierie des produits. Mais aussi, de la chimie et de la microstructure à trouver à la surface, le tout en passant par la fabrication et par la stérilisation.
Il en résulte une solution clinique unique et bien documentée, vérifiée dans le cadre d’un parcours « in vitro-in vivo-clinique ».
Bibliographie
Ratner, B.D., Hoffman, A.S., Schoen, F.J., Lemons, J.E. (éd.). Biomaterials Science: An Introduction to Materials in Medicine. Academic Press, San Diego–Londres–Boston–New York–Sydney–Tokyo–Toronto, 1996.
Monographie classique « Biomaterials Science: An Introduction to Materials in Medicine », éditée par B.D. Ratner et al. – 2004 – Elsevier Academic Press.