Biomateriály v medicíně a stomatologii
Obsah
Biomateriály jsou základem moderní rekonstrukční medicíny a stomatologie. Jejich použití sahá od srdečních chlopní a kloubních endoprotéz až po intraoseální implantáty, senzory, elektrody a systémy pro podávání léků. Cílem tohoto článku je poskytnout stručný, ale komplexní přehled jejich definice, požadavků na biokompatibilitu, primárních tříd, mechanismů interakce s tělem, testování a principů degradace, jakož i zdůraznit klíčové aspekty povrchového inženýrství a přesné výroby, které určují klinický úspěch produktu. Článek vychází z klasické monografie „Biomaterials Science: An Introduction to Materials in Medicine“ (Věda o biomateriálech: Úvod do materiálů v medicíně), kterou editovali B.D. Ratner et al. (Academic Press).
Biomateriály by měly být vždy analyzovány v kontextu jejich klinického použití, v konkrétním biologickém prostředí a po absolvování skutečných výrobních a sterilizačních procesů, protože tyto fáze určují jejich funkční vlastnosti a bezpečnost.

Co je biomateriál a co je biokompatibilita?
V terminologii přijaté v literatuře je biomateriál neživý materiál určený k interakci s biologickým systémem v lékařském zařízení. Jeho klinická přijatelnost závisí na biokompatibilitě, tj. schopnosti vyvolat vhodnou, záměrně požadovanou reakci hostitele v dané aplikaci, tj. takovou, která umožňuje zamýšlený terapeutický účinek a nevytváří nepřijatelné riziko. Tyto definice, stanovené mimo jiné v pracích D.F. Williamse a v úvodních kapitolách monografií, se staly základním kamenem interdisciplinárního rozvoje tohoto oboru.
Biokompatibilita je vztah materiál–zařízení–pacient–aplikace; stejný materiál může být biokompatibilní v jednom produktu a problematický v jiném.
Historicky biomateriály zahrnovaly jak kovy používané v protetice (např. zlato v zubním lékařství), tak materiály jako sklo nebo dřevo v externích protézách. Současné chápání této disciplíny se vyvinulo souběžně s krystalizací vědecké komunity, sympozií a založením vědeckých společností; současně se formovala struktura odborné literatury a norem.
Systematika materiálů používaných v medicíně a stomatologii zahrnuje: kovy, polymery, hydrogely, bioresorbovatelné materiály, keramiku a sklokeramiku, přírodní materiály, kompozity, jakož i tenké vrstvy, povlaky a povrchové štěpy, textilie a funkční materiály (aktivně reagující na podněty). To je shrnuto v části I monografie a podrobné kapitoly pojednávají o charakteristikách, vlastnostech a aplikacích jednotlivých tříd.
V klinické praxi se materiál málokdy vyskytuje samostatně, ale tvoří zdravotnický prostředek se specifickou geometrií, drsností, čistotou a historií zpracování; například kapitoly v částech II a VII popisují cévní implantáty, elektrody, senzory, zubní a ortopedické implantáty a systémy pro podávání léků.
Kovy (např. oceli Cr–Ni–Mo, slitiny Co–Cr, slitiny titanu) zůstávají základem pro mechanicky zatížené implantáty (dlahy, šrouby, endoprotézy, komponenty chlopní). Mechanické vlastnosti, únavová životnost a odolnost proti korozi jsou prvořadé a jejich úroveň silně závisí na historii zpracování (od tavení přes plastické tváření až po tepelné zpracování) a mikrostruktuře.
Polymery (od termoplastů po elastomery a síťované pryskyřice) poskytují flexibilitu, nízkou hustotu, snadnou tvarovatelnost a schopnost modifikovat mikrostrukturu a funkci (např. hemokompatibilní povlaky, vodivé gely, membrány). Kapitoly o polymerech zdůrazňují význam molekulové hmotnosti (Mn, Mw), polydisperzity a taktičnosti pro mechanické a zpracovatelské vlastnosti. Z provozního hlediska jsou rozhodující skelný přechod (Tg), krystalické tání (Tm) a gumové plató, které jsou viditelné v testech DMA.
Keramika a sklokeramika, od oxidů (jako je oxid hlinitý a oxid zirkoničitý) po bioaktivní skla, jsou zásadní v aplikacích, kde je vyžadována vysoká tvrdost, chemická stabilita a bioaktivita, např. v restaurativní stomatologii a při opravách kostních defektů. Tyto materiály mohou vytvářet silnou, chemicky zprostředkovanou vazbu s tkání (bioaktivita), což je podrobně popsáno v kurzu „biokeramika“.
Přírodní materiály (kolagen, elastin, polysacharidy) získávají na významu v tkáňovém inženýrství díky své podobnosti s extracelulární matricí a svému potenciálu podporovat regeneraci (např. kožní nebo nervové nosné struktury).
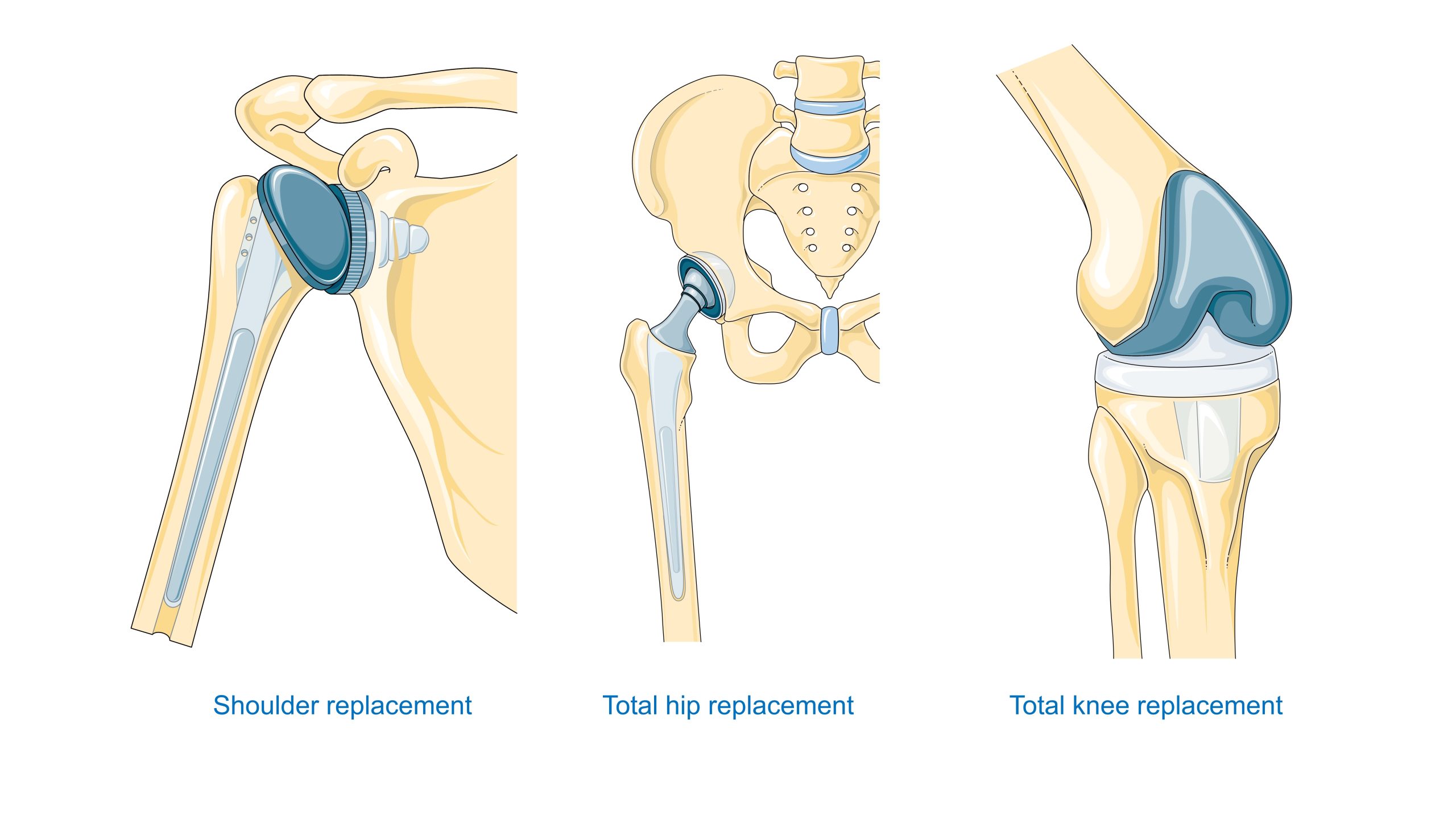
Výběr materiálu souvisí s anatomickou polohou a namáháním: srdeční chlopně vyžadují odolnost proti únavě a srážení krve; endoprotézy kyčle vyžadují vysokou pevnost a vhodné třecí páry; zubní implantáty vyžadují biointegraci a biologickou těsnost průchodu měkké tkáně. Kapitola VII obsahuje podrobný popis těchto požadavků pro konkrétní typy výrobků.
Objemové a povrchové vlastnosti
U biomateriálů rozlišujeme mezi objemovými vlastnostmi (pevnost, modul, rázová pevnost, tečení, únava a vodivost) a povrchovými vlastnostmi (povrchová energie a chemické složení, náboj, topografie a mezní vrstva po adsorpci proteinů). Ty určují první kontakt s krví a tkáněmi – kaskádu adsorpce proteinů, aktivaci buněk a koagulační kaskádu. Monografie obsahuje kapitoly věnované adsorpci proteinů a reakci krve na materiál, jakož i korelacím mezi povrchovými vlastnostmi a biologickou reakcí.
U polymerů určují mechanické a tepelné reakce architektura makromolekul (lineární, rozvětvená nebo zesítěná), krystalinita, taktičnost a distribuce molekulové hmotnosti. Z technického hlediska jsou rozhodující parametry ovlivňující zpracování (např. vstřikování, vytlačování nebo reaktivní formování) a chování během životního cyklu produktu. Rozložení Mn/Mw, Tg a Tm, stejně jako spektra DMA, slouží jako základ pro navrhování membránových struktur, povlaků a implantovatelných elastomerů.
I nepatrné rozdíly v povrchových vlastnostech (chemické složení, nanotextura, historie sterilizace) mohou radikálně změnit profil adsorpce bílkovin a následně ovlivnit trombogenicitu a hojení, proto je řízení stavu povrchu stejně důležité jako výběr chemického složení materiálu.
Jak tělo reaguje na biomateriál?
Po implantaci se spustí řetězec reakcí hostitele, včetně hemostázy, akutního zánětu, proliferace a remodelace tkáně v přítomnosti cizího tělesa. Výsledkem je reakce na cizí těleso, charakterizovaná chronickou aktivací makrofágů, tvorbou obřích buněk cizího tělesa a vývojem fibrózní kapsle. Samostatné, komplexní procesy zahrnují kontakt s krví (aktivace krevních destiček a koagulační kaskáda) a imunitním systémem (imunologie a komplementový systém). Souhrn kapitol 4.1–4.7 poskytuje koncepční rámec a metody pro hodnocení této reakce.
Vzor reakce závisí na místě implantace, velikosti a drsnosti, jakož i na složení materiálu a stavu povrchu; i stejný materiál může vyvolat různé fenotypy makrofágů v měkké tkáni a periostální tkáni. Proto musí být hodnocení biokompatibility specifické pro danou aplikaci (in vitro + in vivo).
Testování biomateriálů zahrnuje studie in vitro (buňky, proteiny a hemokompatibilita), studie in vivo (zvířecí modely a místa implantace), testy krev–materiál a návrh zvířecích modelů přizpůsobených klinické indikaci. Pokyny shromážděné v oddílech 5.1–5.5 stanoví společný jazyk pro akademické a průmyslové laboratoře, jakož i pro regulační hodnocení. Výsledky z jedné úrovně (např. in vitro) nelze přímo extrapolovat na klinické výsledky; triangulace dat (in vitro–in vivo–analýza explantátů) je zlatým standardem ve vývoji a dohledu nad produkty.
Degradace a stárnutí v biologickém prostředí
Tělo není jednoduchým prostředím pro návrh materiálů. Je bohaté na proteiny, enzymy a buňky schopné generovat reaktivní formy kyslíku a chloru. V tomto prostředí jsou materiály vystaveny hydrolýze, oxidaci, korozi, únavě, praskání v napětí a dokonce i patologické mineralizaci. Oddíl 6.1–6.5 poskytuje průřezový přehled mechanismů degradace polymerů, kovů a keramiky.
Zvláště poučný je mechanismus, kterým hostitelský polymer oxiduje. Při akutním zánětu produkují neutrofily superoxidový anion, peroxid vodíku a (za účasti myeloperoxidázy) kyselinu chlornou (HOCl); makrofágy, které dominují chronicky (spolu s obřími buňkami), udržují emisi volných radikálů a adheze MPO k povrchu cizího tělesa může poskytovat katalyzátor v místě implantace. Toto prostředí podporuje oxidaci etherových a urethanových vazeb, jakož i vznik trhlin a trhlin způsobených napětím v urethanových elastomerech, což jsou jevy pozorované mimo jiné v polyuretanových součástech elektrod a elektrodách kardiostimulátorů.
Degradace je synergická: střídavé zatížení způsobuje vznik mikrotrhlin a nového reaktivního povrchu; absorpce vody mění místní pH a usnadňuje difúzi reagencií; produkty hydrolýzy zvyšují hydrofilnost a pronikání degradačních činidel. Pro dlouhodobou bezpečnost je rozhodující kontrola složení, stabilizace antioxidanty a podmínky zbytkového napětí.
U korozivních kovů zahrnuje degradace důlkovou a štěrbinovou korozi, korozní namáhání a tribologické opotřebení v třecích párech, což může vést k uvolnění částic a tkáňovým reakcím. Keramika je sice chemicky stabilnější, ale je křehká a citlivá na defekty způsobující vznik trhlin; proto její konstrukce vyžaduje přísnou kontrolu defektů.
Příklady klinických aplikací
Kardiovaskulární systém. Materiály pro chlopně, štěpy, stenty, mimotělní systémy a umělé orgány musí dosáhnout rovnováhy mezi hemokompatibilitou a mechanickou odolností, jakož i odolností proti usazování bílkovin/buněk. Netrombogenní strategie zahrnují povrchové úpravy (například heparinizace a hydrogely) a kontrolu povrchové energie.
Stomatologie – Implantáty z titanu a zirkonia způsobily revoluci v protetické rehabilitaci. Úspěch závisí na biointegraci s kostí (přesněji řečeno na těsné adhezi a mechanické retenci) a těsnosti průchodu sliznicí. Materiály pro restaurování (ušlechtilá keramika, sklokeramika) těží z pokroku v oblasti biokeramiky a přesného obrábění.
Ortopedie – Endoprotézy kyčle a kolene vyžadují kompromis mezi statickou a únavovou pevností, odolností proti opotřebení a tribologickými vlastnostmi třecího páru (kov–UHMWPE polyethylen, keramika–keramika, kov–kov). Kromě toho je rozhodující spojení s kostí: srovnání akrylového cementu s porézními povlaky pro osseointegraci.
Přesná výroba, mikrostruktura a povrchové inženýrství
V případě kovových implantátů jsou vlastnosti výsledkem celého zpracovatelského řetězce, od tavení a rafinace přes plastickou deformaci a tepelné zpracování až po obrábění, svařování, povlakování a sterilizaci. Mikrostruktura (velikost zrn, fáze, textura) a vady způsobené procesem ovlivňují únavovou pevnost a odolnost proti korozi. Zavedení porézních povlaků a struktur (např. slinuté sítě, plazmové nástřiky) je příkladem interdisciplinárního úkolu: je třeba vyvážit přilnavost, tuhost, topografii a únavovou integritu celé součásti.
U polymerů jsou stejně důležité parametry zpracování (teplota, čas a zbytkové napětí) jako výběr antioxidačních stabilizátorů a kontrola čistoty, protože tyto faktory určují následnou biostabilitu. V praxi se vyskytly případy praskání polyuretanů používaných v elektrodách kardiostimulátorů v důsledku napětí, konkrétně na rozhraní mezi zbytkovými napětími, biologickým prostředím a oxidací hostitelem.
Povrchové inženýrství je soubor nástrojů pro úpravu vlastností, od fyzikálně-chemických povlaků po nanášení tenkých vrstev a roubovaných polymerních vrstev, jakož i mikro/nano topografie. Korelace mezi povrchovými parametry a biologickou reakcí jsou předmětem specializovaných praktických kapitol.
U dlouhodobě implantovaných zařízení mohou malé rozhodnutí týkající se procesu (např. typ sterilizace, podmínky skladování a stárnutí) stát se hlavními příčinami klinických rozdílů o několik let později; dokumentace historie zpracování a kontrola kvality jsou nedílnou součástí návrhu biomateriálu.
Etika, předpisy a normy
Výrobky jsou uváděny na trh v rámci přísných systémů hodnocení, včetně FDA a ISO. Náklady na prokázání bezpečnosti a účinnosti jsou značné, ale chrání pacienty a formují politiku kvality. Zároveň vyvstávají etické otázky: jak vyvážit zájmy pacientů a ekonomický tlak, jak navrhnout studie s minimálním rizikem, kdy a jak stáhnout zastaralá řešení. Tyto otázky, spolu s rolí konsensuálních norem a technologického vývoje, jsou diskutovány v části věnované novým produktům a normám. Klinický pokrok vyžaduje současný pokrok v metodice hodnocení, normách a etice; jinak může být inovace iluzorní nebo riskantní.
Perspektivy
Na obzoru jsou biologicky funkční (na podněty reagující) materiály a pokročilé systémy biosenzorů a umělých orgánů (implantabilní a mimotělní), které činí z rozhraní biomateriálu centrum fyziologické informatiky. Jejich úspěch bude záviset na jemné kontrole povrchových interakcí, dlouhodobé stabilitě a ochraně před degradací. Část monografie věnovaná umělým orgánům a biosenzorům ukazuje, jak úzce musí materiály, elektronika a biologie spolupracovat. Budoucnost biomateriálů spočívá v hybridních systémech, které budou vyžadovat ještě pečlivější kontrolu mikrostruktury a povrchu.
Biomateriály v medicíně a stomatologii – shrnutí
Biomateriály jsou aktivními složkami terapie, které spoluvytvářejí biologické mikroprostředí. Úspěch je stejně určen výběrem třídy materiálu, povrchovým inženýrstvím, mikrostrukturou a historií zpracování, jakož i porozuměním reakci hostitele a mechanismům degradace v průběhu času. Kovy, polymery a keramika přinášejí různé výhody a rizika; přírodní polymery a bioaktivní systémy rozšiřují paletu o regenerační funkce.
Z klinického hlediska představuje každý projekt problém optimalizace více cílů pro konkrétní indikaci a populaci pacientů, který monografie systematizuje, počínaje definicemi a vlastnostmi, přes kontaktní biologii a testování, až po praktické aspekty implantace a analýzy explantátů. Precizní výroba a kontrola kvality nejsou poslední fází, ale nedílnou součástí vědy o biomateriálech, protože určují dlouhodobé chování materiálu v těle.
Zásadní kompetencí v oblasti návrhu biomateriálů je schopnost kombinovat materiálové vědy s biologií a produktovým inženýrstvím – od chemie a mikrostruktury přes povrch až po výrobu a sterilizaci. Výsledkem je jediné, dobře zdokumentované klinické řešení, ověřené v in vitro–in vivo–klinické cestě.
Bibliografie
Ratner, B.D., Hoffman, A.S., Schoen, F.J., Lemons, J.E. (eds.). Biomaterials Science: An Introduction to Materials in Medicine. Academic Press, San Diego–Londýn–Boston–New York–Sydney–Tokio–Toronto, 1996.