O que é a cristalização do metal?
Índice
A cristalização é um dos fenómenos físico-químicos fundamentais que ocorre nos metais, desempenhando um papel crucial tanto na sua produção como na sua transformação posterior. Este processo, que envolve a transição do metal do estado líquido para o estado sólido através da disposição dos átomos numa estrutura cristalina regular, determina a estrutura e as propriedades do material resultante. Dependendo das condições de solidificação, tais como temperatura, velocidade de arrefecimento e presença de impurezas, o metal pode assumir diferentes formas cristalinas, que por sua vez afetam, entre outras coisas, a sua resistência, suscetibilidade a processos de transformação e propriedades químicas.
Compreender os mecanismos de cristalização é particularmente importante em áreas como metalurgia, fundição, engenharia de materiais e tecnologia de junção. As aplicações práticas desse conhecimento vão desde a produção de aço e ligas especiais até a modelagem controlada da microestrutura de materiais utilizados na indústria aeronáutica e na energia nuclear. Este artigo fornece uma visão geral dos princípios físicos e cinéticos que regem o processo de cristalização dos metais, com base em conhecimentos teóricos e observações práticas.

Base energética das transformações de fase
Os metais, tal como outras substâncias, podem existir em três estados: sólido, líquido e gasoso. A transição de um estado para outro ocorre em condições de temperatura e pressão estritamente definidas, características de cada elemento. À pressão atmosférica, o ponto de fusão e o ponto de ebulição são particularmente importantes, pois são propriedades físicas fundamentais dos metais.
Do ponto de vista termodinâmico, apenas os processos que originam uma diminuição da energia livre do sistema ocorrem espontaneamente. Portanto, a fase formada num determinado sistema tem uma energia livre menor do que a fase anterior. Quanto menor a energia livre, maior a estabilidade de uma determinada fase sob um determinado conjunto de condições.
Para o processo de cristalização, é crucial comparar a energia livre das fases líquida e sólida. Abaixo da temperatura de cristalização (ou seja, o ponto de congelamento), a fase mais estável é a sólida, porque a sua energia livre é menor. Acima dessa temperatura, a fase líquida é mais estável. No ponto de transição, ou seja, a temperatura teórica de cristalização, ambas as energias livres são iguais, o que significa que o líquido e o sólido coexistem em um estado de equilíbrio.
No entanto, para que a cristalização comece, o líquido deve ser sobrearrefecido abaixo do seu ponto de congelamento teórico. A diferença entre as temperaturas teórica e real em que a solidificação começa é chamada de grau de sobrearrefecimento. Da mesma forma, durante a fusão, pode ocorrer sobreaquecimento, ou seja, a temperatura de transição pode subir em relação ao ponto de equilíbrio teórico.
As transições de fase também são acompanhadas por efeitos térmicos – no caso da solidificação, trata-se da liberação de calor latente e, no caso da fusão, da sua absorção. Graças a este fenómeno, aparecem secções horizontais características nos gráficos de aquecimento e arrefecimento, indicando as transformações que estão a ocorrer. Esses gráficos permitem observar e analisar o processo de cristalização ao longo do tempo.
Na prática, também se observa a histerese térmica – um fenómeno em que a temperatura de transição durante o aquecimento difere da temperatura de transição durante o arrefecimento. Isto é um resultado direto do líquido ser sobrearrefecido ou sobreaquecido. Quanto mais lento for o arrefecimento, menor será o grau de sobrearrefecimento e mais próximo estará o processo da teoria.
Nucleação e crescimento de cristais
O processo de cristalização primária, ou seja, a transição do metal líquido para o sólido, ocorre em duas etapas. Consiste na formação de núcleos cristalinos estáveis e no subsequente crescimento de cristais a partir desses núcleos.
A nucleação só ocorre quando a energia total do sistema diminui. Por um lado, a transição da fase líquida para a fase sólida causa uma diminuição da energia livre, o que promove a cristalização. Por outro lado, porém, a formação de uma superfície de fronteira entre o líquido e o cristal gera energia superficial adicional, que tem o efeito oposto: aumenta a energia do sistema.
A cristalização ocorre quando a diminuição da energia livre associada à ordenação dos átomos é superior ao aumento de energia resultante da formação da superfície do embrião. O equilíbrio destas energias é descrito pela fórmula:
\[ \Delta F = -\Delta F_V \cdot V + \sigma \cdot A\]
- \(\Delta F_V\) – diferença na energia livre por unidade de volume,
- \(V\) – volume do embrião,
- \(\sigma\) – tensão superficial,
- \(A\) – área da superfície do núcleo.
Supondo que o núcleo tenha uma forma esférica, é possível calcular o raio crítico do núcleo (rk), que determina a fronteira entre núcleos estáveis e instáveis:
\[r_k = \frac{2\sigma}{\Delta F_V}\]
Apenas núcleos com um raio igual ou superior a rk serão estáveis e capazes de crescer e se transformar em cristais completos. Núcleos menores que rk dissolvem-se de volta no líquido porque a sua existência estaria associada a um aumento na energia do sistema.
O grau de sobrearrefecimento do líquido tem uma influência fundamental no tamanho de rk. Quanto maior o sobrearrefecimento, maior a diferença de energia livre entre o líquido e os cristais e menor o raio crítico. Como resultado, formam-se núcleos mais estáveis, levando a uma cristalização mais rápida e a uma estrutura metálica mais fina.
A presença de inclusões sólidas estranhas no líquido também pode induzir a nucleação. Essas partículas (por exemplo, óxidos, nitretos, rachaduras no molde) podem reduzir a tensão superficial local e facilitar a nucleação heterogênea, mesmo com menos sobrearrefecimento.
Simultaneamente à nucleação, ocorre o crescimento cristalino. Esse processo envolve a adesão de camadas sucessivas de átomos à superfície do núcleo. As deslocações helicoidais são particularmente importantes aqui, pois a sua presença facilita o processo de crescimento. Nesses locais, forma-se uma falha espiral, que atrai átomos adicionais, resultando num crescimento contínuo e eficaz dos cristais. Este fenómeno foi descrito por F.C. Frank e é conhecido como espiral de crescimento.
Fatores que influenciam a cristalização
Embora o processo de cristalização do metal se baseie nos princípios da termodinâmica e da cinética, em condições industriais reais, ele é influenciado por muitas variáveis externas. Esses fatores influenciam tanto o número de núcleos cristalinos formados quanto a taxa de crescimento dos cristais, o que se traduz diretamente na estrutura final do metal solidificado. Os fatores mais importantes incluem:
- A temperatura do metal antes da fundição e o tempo em que ele é mantido nessa temperatura – quanto mais alta a temperatura e mais longo o tempo, maior a possibilidade de remoção de impurezas e mais homogêneas as condições de solidificação.
- A temperatura de fundição afeta o grau de sobrearrefecimento, que por sua vez influencia o número de núcleos e a estrutura dos grãos.
- Método de fundição – técnicas como fundição por gravidade, fundição por sifão ou fundição direcional afetam a distribuição da temperatura no molde, que regula o processo de cristalização.
- Taxa de arrefecimento – um dos parâmetros mais importantes; o arrefecimento rápido promove uma estrutura de grãos finos, enquanto o arrefecimento lento leva a uma estrutura de grãos grossos.
- Tipo e temperatura do molde de fundição – um molde feito de materiais que conduzem bem o calor (por exemplo, metal) e um molde frio aceleram a transferência de calor, aumentando o sobrearrefecimento do líquido.
- Qualidade do metal líquido – a presença de inclusões não metálicas (por exemplo, óxidos, sulfuretos) pode afetar significativamente a nucleação heterogénea, que por sua vez altera a natureza dos grãos formados.
- Tensão superficial do metal à temperatura de solidificação – determina a facilidade de formação de uma superfície de interfase entre o líquido e o núcleo.
- Choques mecânicos, vibrações e ondas ultrassónicas podem aumentar o número de núcleos e acelerar a cristalização, afetando assim a estrutura e a homogeneidade do material.
Embora as relações entre estes fatores e o curso da cristalização sejam teoricamente conhecidas, na prática, as suas interações são complexas e difíceis de prever com certeza. Não existe uma teoria universal única que leve em consideração todas as variáveis simultaneamente.
Para simplificar a descrição do processo de cristalização, G. Tammann propôs dois parâmetros:
- O número de núcleos cristalinos que se formam espontaneamente em uma unidade de volume em um minuto.
- Taxa de cristalização linear, ou seja, a taxa de crescimento dos cristais medida em milímetros por minuto.
Ambas as quantidades dependem estritamente do grau de sobrearrefecimento do líquido. Com o aumento do sobrearrefecimento, tanto o número de núcleos quanto a taxa de cristalização aumentam inicialmente, atingem um máximo e depois diminuem. Em casos extremos, com sobrearrefecimento muito alto, o líquido pode solidificar como um corpo amorfo.
A taxa de arrefecimento é frequentemente tratada como um equivalente aproximado do grau de sobrearrefecimento, permitindo que seja usada na prática como uma ferramenta para controlar a estrutura do material.

Forma e estrutura cristalina das peças fundidas
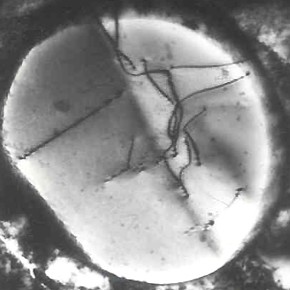
Durante a cristalização, cristais de várias formas se formam a partir do líquido, dependendo das condições térmicas e espaciais em que ocorre a solidificação. A forma cristalina mais comum em metais é a dendrita – estruturas ramificadas que se assemelham a árvores, cujo nome tem origem na palavra grega “dendron” (que significa árvore).
Os cristais dendríticos formam-se porque o crescimento dos cristais ocorre mais rapidamente na direção da dissipação do calor, na maioria das vezes perpendicularmente às paredes do molde. Inicialmente, forma-se o eixo principal da dendrite (primário), a partir do qual se desenvolvem ramos secundários em ângulo, seguidos por ramos terciários, criando uma estrutura característica. À medida que a cristalização avança, as dendritas alongam-se e engrossam até começarem a tocar-se, o que impede o seu crescimento.
Quando os dendritos terminam de crescer, os espaços interdendríticos são preenchidos com o metal líquido restante, que preenche as áreas vazias e também se solidifica. Como resultado, os dendritos transformam-se em grãos cristalinos e a estrutura final do metal consiste em grãos compactados.
Em casos excecionais, quando não há metal líquido suficiente (por exemplo, como resultado da contração durante a solidificação ou na presença de porosidade), os dendritos podem não ser preenchidos. Eles permanecem visíveis e podem ser observados, por exemplo, em cavidades de contração. Existem casos conhecidos de dendritos gigantes, por exemplo, o chamado cristal de Chernov, com 39 cm de comprimento, descoberto na cavidade de retração de um lingote de 100 toneladas.
Com base em observações da solidificação do aço num molde, podem distinguir-se três zonas principais de cristalização na secção transversal do lingote:
- Zona de cristais congelados – uma camada fina de metal nas paredes do molde, que solidifica imediatamente devido ao sobrearrefecimento severo. É constituída por cristais muito finos, dispostos de forma caótica.
- Zona de cristais colunares – formada como resultado do crescimento direcional dos cristais das paredes do molde para o metal. Estes cristais são alongados e perpendiculares às paredes, na direção da transferência de calor.
- Zona de cristais livres – localizada na parte central do lingote, onde não há fluxo de calor direcional. Aqui formam-se poucos cristais maiores e dispostos de forma caótica, que por vezes afundam no fundo do líquido.
À medida que a cristalização avança, a composição química do líquido residual também muda. Os primeiros cristais a cristalizar são relativamente puros, enquanto as impurezas (por exemplo, enxofre, fósforo, carbono) concentram-se no líquido em solidificação por último, geralmente na parte superior do lingote, perto da cavidade de retração. Este fenómeno é conhecido como segregação macroscópica, em oposição à segregação microscópica que ocorre dentro de grãos individuais.
Dependendo do grau de desoxidação e desgaseificação do aço, distinguem-se diferentes tipos de solidificação:
- Aços mortos – bem desgaseificados, solidificam calmamente, com poucas bolhas de gás. Apresentam melhores propriedades e menor teor de impurezas.
- Aços não mortos – “fervendo” intensamente durante a solidificação, com um grande número de bolhas, cuja estrutura se assemelha ao queijo suíço. O seu rendimento é maior, mas as suas propriedades são mais pobres.
- Aços semi-calmados – intermediários entre os anteriores, obtidos por desoxidação parcial, por exemplo, com manganês e alumínio.
Transformações no estado sólido
Alguns metais podem adotar diferentes estruturas cristalinas dependendo da temperatura e da pressão, resultando num fenómeno conhecido como polimorfismo ou alotropia. Isto significa que o mesmo elemento pode cristalizar em várias formas estruturais diferentes, que diferem no tipo de rede espacial.
As variedades alotrópicas individuais são designadas por letras gregas: α, β, γ, etc., que são adicionadas como índices ao símbolo químico. A variedade α é tipicamente estável às temperaturas mais baixas, enquanto as outras formas surgem à medida que a temperatura aumenta.
Cada variedade tem as suas próprias propriedades físicas, químicas e mecânicas características. A transição de uma estrutura para outra – por exemplo, de hexagonal para regular – é um processo comparável à cristalização a partir de um líquido e é chamado de cristalização secundária. Durante este processo, ocorre o seguinte:
- nucleação (formação de uma nova fase),
- crescimento de novos cristais numa estrutura já sólida.
Como as transformações alotrópicas ocorrem em um ambiente sólido, elas podem reter parte da orientação cristalográfica da fase anterior, o que é importante, por exemplo, no tratamento térmico de metais. Essas transformações são frequentemente acompanhadas por efeitos térmicos: liberação de calor durante o arrefecimento e absorção de calor durante o aquecimento.
Nos gráficos de temperatura, isso se manifesta como “paragens de temperatura”, semelhantes às observadas durante a fusão ou solidificação.
Os fenómenos alotrópicos são tecnologicamente importantes porque alteram as propriedades de um material, tais como resistência, dureza ou expansão térmica. Por este motivo, muitos processos térmicos (por exemplo, endurecimento ou recozimento) utilizam a transição controlada entre formas alotrópicas.
As transformações alotrópicas também tendem a sobreaquecer ou arrefecer excessivamente, o que na prática significa que podem não ocorrer exatamente à temperatura de equilíbrio, mas ligeiramente acima dela.
O que é a cristalização do metal – resumo
O processo de cristalização do metal é um fenómeno físico-químico complexo que depende de muitos fatores, tanto termodinâmicos como cinéticos. A energia livre, o grau de sobrearrefecimento, as condições de arrefecimento e a presença de núcleos cristalinos e a sua capacidade de crescimento são de importância fundamental aqui.
A compreensão dos princípios da cristalização permite o controlo da microestrutura de um metal, o que, por sua vez, influencia as suas propriedades mecânicas, tecnológicas e funcionais. Este conhecimento é aplicado, entre outras áreas, na fundição, metalurgia, tecnologia de ligas, soldagem e tratamento térmico.
O exemplo do ferro ilustra claramente como diferentes variedades estruturais e magnéticas influenciam o comportamento de um material, dependendo da temperatura. Portanto, o conhecimento do processo de cristalização e das transformações de fase é fundamental para a engenharia de materiais e essencial na prática industrial.