Biomateriali in medicina e odontoiatria
Indice
I biomateriali sono la colonna portante della moderna medicina ricostruttiva e dell’odontoiatria. Le loro applicazioni spaziano dalle valvole cardiache e dalle endoprotesi articolari agli impianti intraossei, ai sensori, agli elettrodi e ai sistemi di somministrazione dei farmaci. Questo articolo mira a fornire una panoramica concisa ma completa della loro definizione, dei requisiti di biocompatibilità, delle classi primarie, dei meccanismi di interazione con il corpo, dei test e dei principi di degradazione, nonché a evidenziare gli aspetti chiave dell’ingegneria delle superfici e della produzione di precisione che determinano il successo clinico di un prodotto. L’articolo si basa sulla classica monografia “Biomaterials Science: An Introduction to Materials in Medicine” (Scienza dei biomateriali: Introduzione ai materiali in medicina), a cura di B.D. Ratner et al. (Academic Press).
I biomateriali devono sempre essere analizzati nel contesto della loro applicazione clinica, all’interno di un ambiente biologico specifico e dopo aver subito i processi di produzione e sterilizzazione effettivi, poiché queste fasi ne definiscono le proprietà funzionali e la sicurezza.

Che cos’è un biomateriale e che cos’è la biocompatibilità?
Nella terminologia adottata in letteratura, un biomateriale è un materiale inanimato destinato a interagire con un sistema biologico in un dispositivo medico. La sua accettabilità clinica dipende dalla biocompatibilità, ovvero dalla capacità di suscitare una risposta appropriata e deliberatamente desiderata nell’ospite in una data applicazione, ovvero una risposta che consenta l’effetto terapeutico previsto e non generi rischi inaccettabili. Queste definizioni, stabilite nei lavori di D.F. Williams e nei capitoli introduttivi delle monografie, tra gli altri, sono diventate la pietra angolare dello sviluppo interdisciplinare del settore.
La biocompatibilità è una relazione materiale-dispositivo-paziente-applicazione; lo stesso materiale può essere biocompatibile in un prodotto e problematico in un altro.
Storicamente, i biomateriali comprendevano sia i metalli utilizzati nelle protesi (ad esempio l’oro in odontoiatria) sia quelli come il vetro o il legno nelle protesi esterne. L’attuale comprensione della disciplina si è sviluppata di pari passo con la cristallizzazione della comunità scientifica, i simposi e la costituzione di società scientifiche; allo stesso tempo, ha preso forma la struttura della letteratura professionale e degli standard.
La sistematica dei materiali utilizzati in medicina e odontoiatria comprende: metalli, polimeri, idrogel, materiali bioriassorbibili, ceramiche e vetroceramiche, materiali naturali, compositi, nonché strati sottili, rivestimenti e innesti superficiali, tessuti e materiali funzionali (che rispondono attivamente agli stimoli). Ciò è riassunto nella Parte I della monografia, mentre capitoli dettagliati trattano le caratteristiche, le proprietà e le applicazioni delle singole classi.
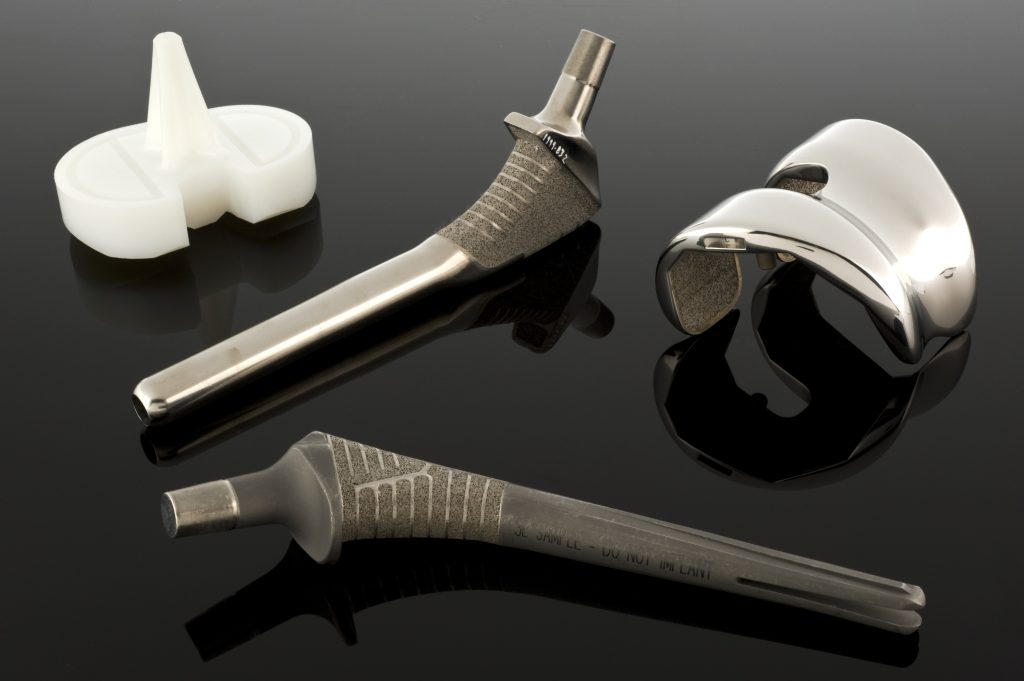
Nella pratica clinica, il materiale raramente si presenta da solo, ma forma un dispositivo medico con una geometria, una rugosità, una purezza e una storia di lavorazione specifiche; ad esempio, i capitoli delle parti II e VII descrivono impianti vascolari, elettrodi, sensori, impianti dentali e ortopedici e sistemi di somministrazione di farmaci.
I metalli (ad esempio acciai Cr-Ni-Mo, leghe Co-Cr, leghe di titanio) rimangono la base per gli impianti sottoposti a sollecitazioni meccaniche (placche, viti, endoprotesi, componenti valvolari). Le proprietà meccaniche, la resistenza alla fatica e la resistenza alla corrosione sono fondamentali e il loro livello dipende fortemente dalla storia di lavorazione (dalla fusione alla lavorazione plastica al trattamento termico) e dalla microstruttura.
I polimeri (dalle materie termoplastiche agli elastomeri e alle resine reticolate) offrono flessibilità, bassa densità, facilità di formatura e la possibilità di modificare la microstruttura e la funzione (ad esempio, rivestimenti emocompatibili, gel conduttivi, membrane). I capitoli sui polimeri sottolineano l’importanza del peso molecolare (Mn, Mw), della polidispersità e della tatticità per le proprietà meccaniche e di lavorazione. Da un punto di vista operativo, la transizione vetrosa (Tg), la fusione cristallina (Tm) e il plateau della gomma, visibili nei test DMA, sono fondamentali.
La ceramica e la vetroceramica, che vanno dagli ossidi (come l’allumina e la zirconia) ai vetri bioattivi, sono fondamentali nelle applicazioni in cui sono richieste elevata durezza, stabilità chimica e bioattività, ad esempio nell’odontoiatria restaurativa e nella riparazione dei difetti ossei. Questi materiali possono formare un legame forte e mediato chimicamente con i tessuti (bioattività), che viene discusso in dettaglio nella lezione “bioceramica”.
I materiali naturali (collagene, elastina, polisaccaridi) stanno acquisendo importanza nell’ingegneria dei tessuti grazie alla loro somiglianza con la matrice extracellulare e al loro potenziale di promuovere la rigenerazione (ad esempio, scaffold cutanei o nervosi).
La scelta del materiale è legata alla posizione anatomica e al regime di sollecitazione: le valvole cardiache richiedono resistenza alla fatica e alla coagulazione del sangue; le endoprotesi dell’anca richiedono un’elevata resistenza e coppie di attrito appropriate; gli impianti dentali richiedono biointegrazione e tenuta biologica del passaggio dei tessuti molli. Il capitolo VII fornisce descrizioni dettagliate di questi requisiti per tipi specifici di prodotti.
Proprietà di volume e di superficie
Nei biomateriali, distinguiamo tra proprietà di volume (resistenza, modulo, resistenza all’urto, scorrimento, fatica e conduttività) e proprietà di superficie (energia e chimica della superficie, carica, topografia e strato limite dopo l’adsorbimento delle proteine). Quest’ultimo determina il primo contatto con il sangue e i tessuti: la cascata di adsorbimento delle proteine, l’attivazione cellulare e la cascata della coagulazione. La monografia include capitoli dedicati all’adsorbimento delle proteine e alla risposta del sangue al materiale, nonché alle correlazioni tra le proprietà superficiali e la risposta biologica.
Nei polimeri, l’architettura delle macromolecole (lineari, ramificate o reticolate), la cristallinità, la tatticità e la distribuzione del peso molecolare determinano le risposte meccaniche e termiche. Da un punto di vista ingegneristico, i parametri che controllano la lavorazione (ad esempio, iniezione, estrusione o stampaggio reattivo) e il comportamento durante il ciclo di vita del prodotto sono fondamentali. Le distribuzioni Mn/Mw, Tg e Tm, così come gli spettri DMA, servono come base per la progettazione di strutture a membrana, rivestimenti ed elastomeri impiantabili.
Anche sottili differenze nelle proprietà superficiali (chimica, nanotexture, storia di sterilizzazione) possono alterare radicalmente il profilo di adsorbimento delle proteine e, di conseguenza, influenzare la trombogenicità e la guarigione, motivo per cui la gestione delle condizioni superficiali è importante quanto la selezione della composizione chimica del materiale.
Come reagisce il corpo al biomateriale?
Applicato l’impianto, viene innescata una catena di reazioni dell’ospite, tra cui emostasi, infiammazione acuta, proliferazione e rimodellamento dei tessuti in presenza di un corpo estraneo. Ciò provoca una reazione da corpo estraneo, caratterizzata dall’attivazione cronica dei macrofagi, dalla formazione di cellule giganti da corpo estraneo e dallo sviluppo di una capsula fibrosa. Processi separati e complessi coinvolgono il contatto con il sangue (attivazione piastrinica e cascata della coagulazione) e il sistema immunitario (immunologia e sistema del complemento). Il compendio dei capitoli 4.1-4.7 fornisce un quadro concettuale e metodi per valutare questa risposta.
Il modello di risposta dipende dal sito di impianto, dalle dimensioni e dalla rugosità, nonché dalla composizione del materiale e dalle condizioni della superficie; anche lo stesso materiale può indurre fenotipi macrofagici diversi nei tessuti molli e nel tessuto periostale. Pertanto, la valutazione della biocompatibilità deve essere specifica per l’applicazione (in vitro + in vivo).
I test sui biomateriali comprendono studi in vitro (cellule, proteine ed emocompatibilità), studi in vivo (modelli animali e siti di impianto), test sangue-materiale e la progettazione di modelli animali su misura per l’indicazione clinica. Le linee guida raccolte nelle sezioni 5.1-5.5 stabiliscono un linguaggio comune per i laboratori accademici e industriali, nonché per la valutazione normativa. I risultati di un livello (ad esempio, in vitro) non possono essere estrapolati direttamente ai risultati clinici; la triangolazione dei dati (analisi in vitro-in vivo-espianto) è il gold standard nello sviluppo e nella supervisione dei prodotti.
Degradazione e invecchiamento in un ambiente biologico
Il corpo non è un ambiente semplice per la progettazione dei materiali. È ricco di proteine, enzimi e cellule in grado di generare specie reattive dell’ossigeno e del cloro. In questo ambiente, i materiali sono soggetti a idrolisi, ossidazione, corrosione, fatica, fessurazione da stress e persino mineralizzazione patologica. Le sezioni 6.1-6.5 forniscono una panoramica trasversale dei meccanismi di degradazione di polimeri, metalli e ceramiche.
Particolarmente istruttivo è il meccanismo con cui il polimero ospite si ossida. Nell’infiammazione acuta, i neutrofili producono anione superossido, perossido di idrogeno e (con la partecipazione della mieloperossidasi) acido ipocloroso (HOCl); i macrofagi, che dominano in modo cronico (insieme alle cellule giganti), sostengono l’emissione di radicali liberi e l’adesione della MPO alla superficie del corpo estraneo può fornire un catalizzatore nel sito di impianto. Questo ambiente favorisce l’ossidazione dei legami etere e uretano, nonché l’insorgenza di crepe e fessurazioni da stress negli elastomeri uretanici, fenomeni osservati, tra l’altro, nei componenti in poliuretano degli elettrodi e dei cavi dei pacemaker.
Il degrado è sinergico: i carichi alternati producono microfessurazioni e una superficie fresca e reattiva; l’assorbimento di acqua altera il pH locale e facilita la diffusione dei reagenti; i prodotti dell’idrolisi aumentano l’idrofilia e la penetrazione degli agenti di degrado. Il controllo della composizione, la stabilizzazione antiossidante e le condizioni di stress residuo sono fondamentali per la sicurezza a lungo termine.
Nei metalli corrosivi, il degrado comprende la corrosione puntiforme e interstiziale, la corrosione da tensione e l’usura tribologica nelle coppie di attrito, che può portare alla formazione di particelle libere e reazioni tissutali. Le ceramiche, sebbene chimicamente più stabili, sono fragili e sensibili ai difetti che causano la formazione di crepe; pertanto, la loro progettazione richiede un rigoroso controllo dei difetti.
Esempi di applicazioni cliniche
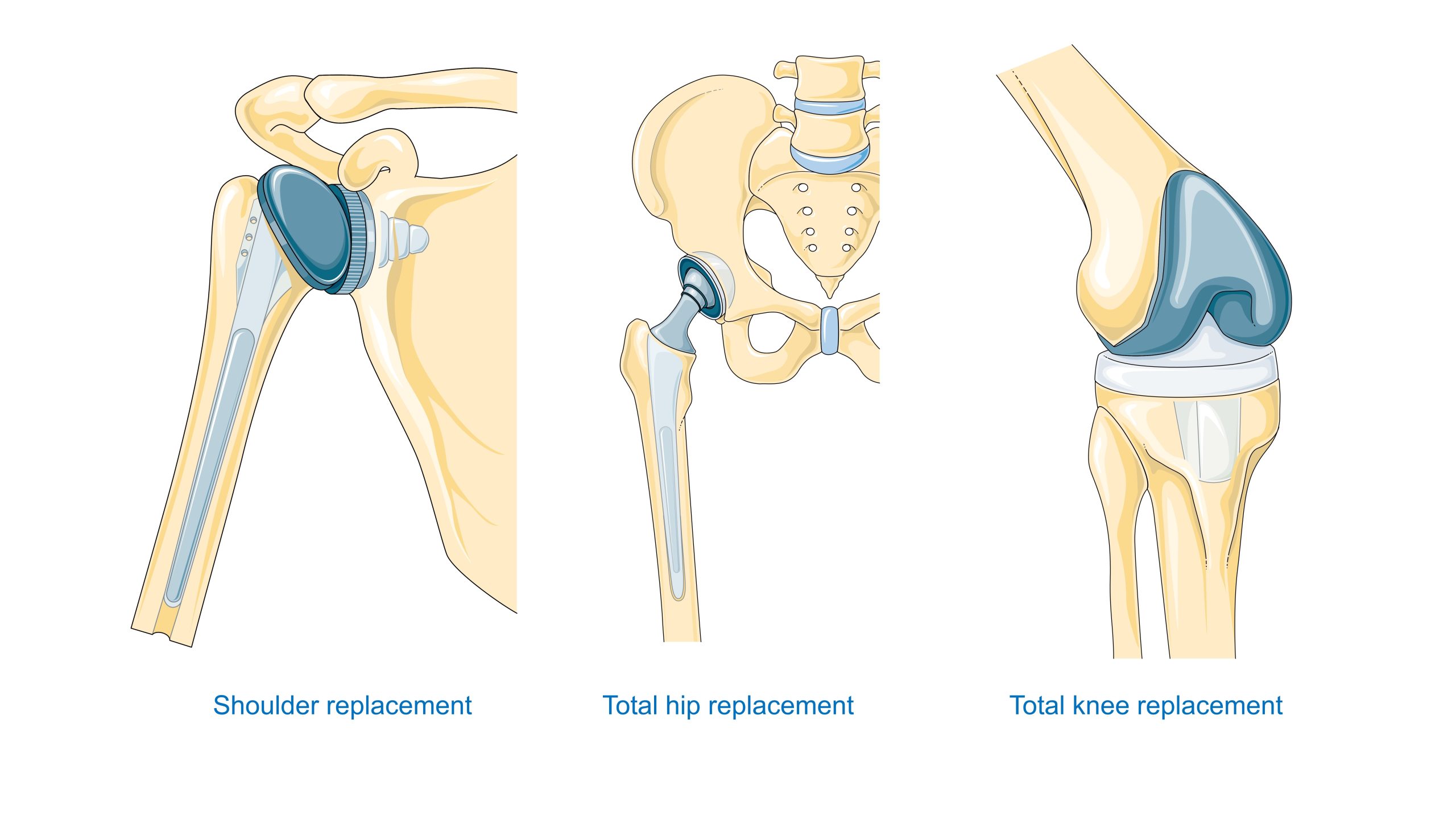
Sistema cardiovascolare. I materiali per valvole, innesti, stent, sistemi extracorporei e organi artificiali devono trovare un equilibrio tra emocompatibilità e durata meccanica, nonché resistenza alla deposizione di proteine/cellule. Le strategie non trombogeniche includono modifiche superficiali (come l’eparinizzazione e gli idrogel) e il controllo dell’energia superficiale.
Odontoiatria – gli impianti in titanio e zirconio hanno rivoluzionato la riabilitazione protesica. Il successo dipende dalla biointegrazione con l’osso (più precisamente, dall’adesione stretta e dalla ritenzione meccanica) e dalla tenuta del passaggio attraverso la mucosa. I materiali per i restauri (ceramiche preziose, vetroceramiche) beneficiano dei progressi nella bioceramica e nella lavorazione di precisione.
Ortopedia – Le endoprotesi dell’anca e del ginocchio richiedono un compromesso tra resistenza statica e alla fatica, resistenza all’usura e proprietà tribologiche della coppia di attrito (metallo-polietilene UHMWPE, ceramica-ceramica, metallo-metallo). Inoltre, il collegamento con l’osso è fondamentale: confronto tra cemento acrilico e rivestimenti porosi per l’osteointegrazione.
Produzione di precisione, microstruttura e ingegneria delle superfici
Nel caso degli impianti metallici, le proprietà derivano dall’intera catena di lavorazione, dalla fusione e raffinazione alla deformazione plastica e al trattamento termico, fino alla lavorazione, saldatura, rivestimento e sterilizzazione. La microstruttura (dimensione dei grani, fasi, struttura) e i difetti indotti dal processo influenzano la resistenza alla fatica e la resistenza alla corrosione. L’introduzione di rivestimenti e strutture porose (ad esempio reti sinterizzate, spruzzi al plasma) è un esempio di attività interdisciplinare: l’adesione, la rigidità, la topografia e l’integrità alla fatica dell’intero componente devono essere bilanciate.
Nei polimeri, i parametri di lavorazione (temperatura, tempo e sollecitazioni residue) sono altrettanto importanti, così come la selezione di stabilizzanti antiossidanti e il controllo della purezza, poiché questi fattori determinano la successiva biostabilità. In pratica, si sono verificati casi di fessurazione da stress nei poliuretani utilizzati nei cavi dei pacemaker, in particolare all’interfaccia tra le sollecitazioni residue, l’ambiente biologico e l’ossidazione da parte dell’ospite.
L’ingegneria delle superfici è un insieme di strumenti per la modifica delle proprietà, che vanno dai rivestimenti fisico-chimici all’applicazione di film sottili e strati polimerici innestati, nonché alla micro/nano topografia. Le correlazioni tra i parametri superficiali e la risposta biologica sono oggetto di capitoli pratici dedicati.
Per i dispositivi impiantati a lungo termine, piccole decisioni di processo (ad esempio, tipo di sterilizzazione, condizioni di invecchiamento durante lo stoccaggio) possono diventare cause importanti di differenze cliniche anni dopo; la documentazione della storia di lavorazione e il controllo di qualità sono parte integrante della progettazione dei biomateriali.
Etica, normative e standard
I prodotti vengono immessi sul mercato dopo essere stati sottoposti a rigorosi sistemi di valutazione, tra cui FDA e ISO. Il costo per dimostrare la sicurezza e l’efficacia è significativo, ma protegge i pazienti e definisce la politica di qualità. Allo stesso tempo, sorgono questioni etiche: come bilanciare gli interessi dei pazienti e le pressioni economiche, come progettare studi con rischi minimi, quando e come ritirare soluzioni obsolete. Queste questioni, insieme al ruolo degli standard di consenso e dello sviluppo tecnologico, sono discusse nella sezione sui nuovi prodotti e standard. Il progresso clinico richiede un progresso simultaneo nella metodologia di valutazione, negli standard e nell’etica; altrimenti, l’innovazione potrebbe essere illusoria o rischiosa.
Prospettive
All’orizzonte si profilano materiali biologicamente funzionali (sensibili agli stimoli) e sistemi avanzati di biosensori e organi artificiali (impiantabili ed extracorporei) che rendono l’interfaccia biomateriale il centro dell’informatica fisiologica. Il loro successo dipenderà dal controllo sottile delle interazioni superficiali, dalla stabilità a lungo termine e dalla protezione contro il degrado. La sezione della monografia dedicata agli organi artificiali e ai biosensori mostra quanto i materiali, l’elettronica e la biologia debbano lavorare in stretta collaborazione. Il futuro dei biomateriali risiede nei sistemi ibridi, che richiederanno un controllo ancora più meticoloso della microstruttura e della superficie.
Biomateriali in medicina e odontoiatria – sintesi
I biomateriali sono componenti attivi della terapia che co-creano il microambiente biologico. Il successo è determinato in egual misura dalla scelta della classe di materiale, dall’ingegneria delle superfici, dalla microstruttura e dalla storia di lavorazione, nonché dalla comprensione della risposta dell’ospite e dei meccanismi di degradazione nel tempo. I metalli, i polimeri e le ceramiche presentano diversi vantaggi e rischi; i polimeri naturali e i sistemi bioattivi ampliano la gamma con funzioni rigenerative. Da un punto di vista clinico, ogni progetto presenta un problema di ottimizzazione multi-obiettivo per una specifica indicazione e popolazione di pazienti, che la monografia sistematizza, passando dalle definizioni e proprietà, attraverso la biologia di contatto e i test, agli aspetti pratici dell’impianto e dell’analisi dell’espianto. Infine, la produzione di precisione e il controllo di qualità non sono l’ultima fase, ma parte integrante della scienza dei biomateriali, poiché determinano il comportamento a lungo termine del materiale nel corpo.
La competenza fondamentale nella progettazione dei biomateriali è la capacità di combinare la scienza dei materiali con la biologia e l’ingegneria dei prodotti, dalla chimica e microstruttura, alla superficie, alla produzione e alla sterilizzazione. Ciò si traduce in un’unica soluzione clinica ben documentata, verificata nel percorso in vitro-in vivo-clinico.
Bibliografia
Ratner, B.D., Hoffman, A.S., Schoen, F.J., Lemons, J.E. (a cura di). Biomaterials Science: An Introduction to Materials in Medicine. Academic Press, San Diego–Londra–Boston–New York–Sydney–Tokyo–Toronto, 1996.




