Biomateriaalit lääketieteessä ja hammaslääketieteessä
Sisällysluettelo
Biomateriaalit ovat modernin rekonstruktiivisen lääketieteen ja hammaslääketieteen keskeinen perusta. Niiden sovellukset ulottuvat sydänläpistä ja nivelendoproteeseista luunsisäisiin implantteihin, antureihin, elektrodeihin ja lääkeannostelujärjestelmiin. Tämän artikkelin tarkoituksena on tarjota tiivis mutta kattava yleiskatsaus niiden määritelmään, biologisen yhteensopivuuden vaatimuksiin, pääluokkiin, vuorovaikutusmekanismeihin kehon kanssa, testaukseen ja hajoamisperiaatteisiin sekä pintatekniikan ja tarkkuustuotannon avaintekijöiden esittelyyn, jotka määräävät tuotteen kliinisen menestyksen. Artikkeli perustuu klassiseen monografiaan ”Biomaterials Science: An Introduction to Materials in Medicine” (Biomateriaalitiede: Johdanto lääketieteen materiaaleihin), toim. B.D. Ratner et al. (Academic Press).
Biomateriaaleja tulisi aina analysoida niiden kliinisen sovelluksen kontekstissa, tietyssä biologisessa ympäristössä ja vasta sen jälkeen, kun ne ovat käyneet läpi varsinaisen valmistus- ja sterilointiprosessin, sillä nämä vaiheet määrittävät niiden toiminnalliset ominaisuudet ja turvallisuuden.

Mikä on biomateriaali ja mikä on biokompatibiliteetti?
Kirjallisuudessa käytetyn terminologian mukaan biomateriaali on eloton materiaali, joka on tarkoitettu vuorovaikutukseen biologisen järjestelmän kanssa lääketieteellisessä laitteessa. Sen kliininen hyväksyttävyys riippuu biokompatibiliteetista, eli kyvystä saada aikaan sovellukseen nähden tarkoituksenmukainen ja hallittu isäntävaste, sellainen, joka mahdollistaa aiotun terapeuttisen vaikutuksen eikä aiheuta kohtuutonta riskiä. Nämä määritelmät, jotka on vahvistettu muun muassa D.F. Williamsin teoksissa ja monografioiden johdantokappaleissa, ovat tulleet alan monitieteellisen kehityksen kulmakiveksi.
Biokompatibiliteetti on materiaalin, laitteen, potilaan ja sovelluksen välinen suhde; sama materiaali voi olla biokompatibelinen yhdessä tuotteessa ja osoittautua ongelmalliseksi toisessa.
Historiallisesti biomateriaalit ovat sisältäneet sekä proteeseissa käytettyjä metalleja (esim. kultaa hammaslääketieteessä) että materiaaleja kuten lasia tai puuta ulkoisissa proteeseissa. Nykyinen ymmärrys alasta on kehittynyt samanaikaisesti tiedeyhteisön, symposiumien ja tiedeseurojen vakiintumisen kanssa; samaan aikaan ammattikirjallisuuden ja standardien rakenne on muotoutunut selkeäksi ja systemaattiseksi.
Lääketieteessä ja hammaslääketieteessä käytettävien materiaalien systematiikka sisältää: metallit, polymeerit, hydrogeelit, biologisesti resorboituvat materiaalit, keramiikka ja lasikeramiikka, luonnonmateriaalit, komposiitit sekä ohutkerrokset, pinnoitteet ja pintasiirteet, tekstiilit ja funktionaaliset materiaalit (jotka reagoivat aktiivisesti ärsykkeisiin). Tämä on tiivistetty monografian osassa I, ja yksityiskohtaisissa luvuissa käsitellään kunkin materiaaliluokan ominaisuuksia ja sovelluksia.
Kliinisessä käytännössä materiaali esiintyy harvoin yksinään, vaan muodostaa lääkinnällisen laitteen, jolla on tietty geometria, karheus, puhtaus ja käsittelyhistoria. Esimerkiksi osien II ja VII luvuissa kuvataan verisuonimplantteja, elektrodeja, antureita, hammas- ja ortopedisiä implantteja sekä lääkeannostelujärjestelmiä.
Metallit (esim. Cr–Ni–Mo-teräkset, Co–Cr-seokset, titaaniseokset) ovat edelleen mekaanisesti kuormitettujen implanttien (levyt, ruuvit, endoproteesit, venttiilikomponentit) perusta. Mekaaniset ominaisuudet, väsymisikä ja korroosionkestävyys ovat ensiarvoisen tärkeitä, ja niiden taso riippuu vahvasti käsittelyhistoriasta (sulattamisesta muovausprosessiin ja lämpökäsittelyyn) ja mikrorakenteesta.
Polymeerit (termoplastisista muoveista elastomeereihin ja silloitettuihin hartseihin) tarjoavat joustavuutta, alhaisen tiheyden, muovattavuuden ja kyvyn muokata mikrorakennetta ja toimintaa (esim. hemokompatibelit pinnoitteet, johtavat geelit, kalvot). Polymeerejä käsittelevissä luvuissa korostetaan molekyylipainon (Mn, Mw), polydispersiteetin ja taktiikan merkitystä mekaanisten ja prosessointia koskevien ominaisuuksien kannalta. Käytännön kannalta kriittisiä ovat lasittumislämpötila (Tg), kiteisen sulamislämpötila (Tm) ja kumitaso, jotka näkyvät DMA-testeissä.
Keraamit ja lasikeraamit, jotka vaihtelevat oksideista (kuten alumiinioksidi ja zirkoniumoksidi) bioaktiivisiin lasiin, ovat tärkeitä sovelluksissa, joissa vaaditaan suurta kovuutta, kemiallista stabiilisuutta ja bioaktiivisuutta, esim. hammashoidossa ja luuvaurioiden korjaamisessa. Nämä materiaalit voivat muodostaa vahvan, kemiallisesti välittyvän sidoksen kudoksen kanssa (bioaktiivisuus), jota käsitellään yksityiskohtaisesti luokassa ”biokeraamit”.
Luonnolliset materiaalit (kollageeni, elastiini, polysakkaridit) ovat saamassa yhä enemmän merkitystä kudostekniikassa, koska ne ovat samankaltaisia solunulkoisen matriisin kanssa ja voivat edistää uudistumista (esim. iho- tai hermorakenteet).
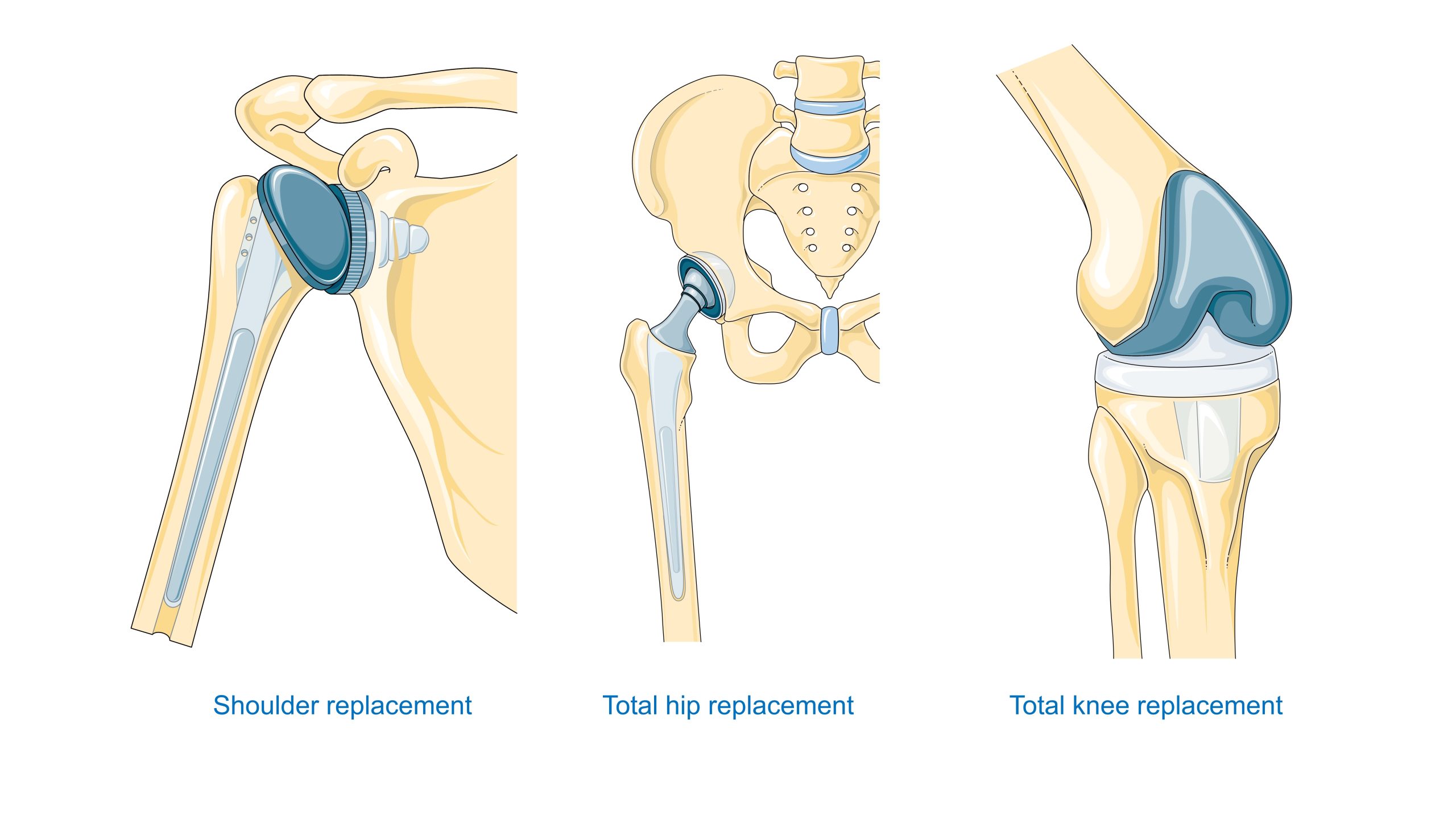
Materiaalin valinta liittyy anatomiseen sijaintiin ja rasitusolosuhteisiin: sydänläpät vaativat väsymis- ja hyytymiskestävyyttä; lonkan endoproteesit vaativat suurta lujuutta ja sopivia kitkapareja; hammasimplantit vaativat biointegraatiota ja pehmytkudoksen läpäisykyvyn biologista tiiviyttä. Luvussa VII on yksityiskohtaiset kuvaukset näistä vaatimuksista tietyntyyppisille tuotteille.
Tilavuus- ja pintaominaisuudet
Biomateriaaleissa erotetaan tilavuusominaisuudet (lujuus, moduuli, iskulujuus, viruminen, väsyminen ja johtavuus) ja pintaominaisuudet (pintaenergia ja -kemia, varaus, topografia ja proteiinin adsorptiota seuraava rajakerros). Jälkimmäiset määräävät ensimmäisen kosketuksen veren ja kudosten kanssa – proteiinin adsorptiota, solujen aktivaatiota ja hyytymiskaskadia seuraavan ketjureaktion. Monografiassa on lukuja, jotka käsittelevät proteiinin adsorptiota ja veren reaktiota materiaaliin sekä pinnan ominaisuuksien ja biologisen reaktion välisiä korrelaatioita.
Polymeerien kohdalla makromolekyylien rakenne (lineaarinen, haarautunut tai silloitettu), kiteisyys, taktiikka ja molekyylipainojakauma määräävät mekaaniset ja termiset reaktiot. Teknisestä näkökulmasta prosessointia (esim. ruiskutus, suulakepuristus tai reaktiivinen muovaus) ja käyttäytymistä tuotteen elinkaaren aikana ohjaavat parametrit ovat kriittisiä. Mn/Mw-, Tg- ja Tm-jakaumat sekä DMA-spektrit toimivat perustana membraanirakenteiden, pinnoitteiden ja implantoitavien elastomeerien suunnittelulle.
Jopa pienet erot pinnan ominaisuuksissa (kemia, nanotekstuurit, sterilointihistoria) voivat muuttaa radikaalisti proteiinin adsorptioprofiilia ja vaikuttaa siten trombogeenisuuteen ja paranemiseen, minkä vuoksi pinnan kunnon hallinta on yhtä tärkeää kuin materiaalin kemiallisen koostumuksen valinta.
Miten keho reagoi biomateriaaliin?
Implantoinnin jälkeen käynnistyy ketju isäntäorganismissa tapahtuvia reaktioita, kuten hemostaasi, akuutti tulehdus, proliferaatio ja kudosten uudelleenmuodostuminen vieraan kappaleen läsnä ollessa. Tämä johtaa vierasesineeseen reaktioon, jolle on ominaista makrofagien krooninen aktivaatio, vierasesineiden jättisolujen muodostuminen ja kuitumaisen kapselin kehittyminen. On kuitenkin huomattava, että osa biomateriaaleista, kuten bioaktiiviset keraamit ja titaanipinnoitteet, voivat integroitua kudokseen ilman merkittävää kapselointia. Erilliset, monimutkaiset prosessit liittyvät kosketukseen veren (verihiutaleiden aktivaatio ja hyytymiskaskadi) ja immuunijärjestelmän (immunologia ja komplementtijärjestelmä) kanssa. Luvuissa 4.1–4.7 esitetään käsitteellinen viitekehys ja menetelmät tämän reaktion arvioimiseksi.
Vierasesinereaktion laajuus ja tyyppi riippuvat implantin sijainnista, koosta ja karheudesta sekä materiaalin koostumuksesta ja pinnan kunnosta; jopa sama materiaali voi indusoida erilaisia makrofagifenotyyppejä pehmytkudoksessa ja periosteaalikudoksessa. Siksi biologisen yhteensopivuuden arvioinnin on oltava aina sovelluskohtainen (in vitro + in vivo).
Biomateriaalien testaus sisältää in vitro -tutkimukset (solut, proteiinit ja hemokompatibiliteetti), in vivo -tutkimukset (eläinmallit ja implanttikohdat), veri-materiaali -testit sekä kliiniseen käyttöaiheeseen räätälöityjen eläinmallien suunnittelun. Kohdissa 5.1–5.5 kootut ohjeet luovat yhteisen kielen akateemisille ja teollisille laboratorioille sekä sääntelyviranomaisten arviointia varten. Yhden tason (esim. in vitro) tuloksia ei voida suoraan yleistää kliinisiin tuloksiin; tietojen kolmiulotteinen analyysi (in vitro–in vivo–eksplantaattianalyysi) on kultainen standardi tuotekehityksessä ja valvonnassa.
Hajoaminen ja vanheneminen biologisessa ympäristössä
Biologinen ympäristö on monimutkainen ja haastava materiaalien suunnittelulle. Se sisältää runsaasti proteiineja, entsyymejä ja soluja, jotka voivat tuottaa reaktiivisia happi- ja klooriyhdisteitä. Tässä ympäristössä materiaalit altistuvat hydrolyysille, hapettumiselle, korroosiolle, väsymiselle, jännitysmurtumille ja jopa patologiselle mineralisoitumiselle. Kohdissa 6.1–6.5 esitetään poikkileikkauskuva polymeerien, metallien ja keraamien hajoamismekanismeista.
Erityisen opettavainen on mekanismi, jonka avulla isäntäpolymeeri hapettuu. Akuutissa tulehduksessa neutrofiilit tuottavat superoksidianionia, vetyperoksidia ja (myeloperoksidaasin osallistuessa) hypokloorihappoa (HOCl); makrofagit, jotka ovat hallitsevassa asemassa kroonisessa tulehduksessa (yhdessä jättisolujen kanssa), ylläpitävät vapaiden radikaalien päästöjä, ja MPO:n tarttuminen vierasesineeseen voi toimia katalyyttinä implantaatiokohdassa. Tämä ympäristö edistää eetteri- ja uretaanisidosten hapettumista sekä halkeamien ja jännityshalkeamien syntymistä uretaanielastomeereissa, ilmiöitä, joita on havaittu muun muassa elektrodien ja sydämentahdistimen johtojen polyuretaanikomponenteissa.
Hajoaminen on synergististä: vaihtelevat kuormitukset tuottavat mikrohalkeamia ja uuden, reaktiivisen pinnan; veden imeytyminen muuttaa paikallista pH:ta ja helpottaa reagenssien diffuusiota; hydrolyysituotteet lisäävät hydrofiilisyyttä ja hajoamisaineiden tunkeutumista. Koostumuksen, antioksidanttien stabiloinnin ja jäännösjännitysolosuhteiden hallinta on kriittistä pitkäaikaisen turvallisuuden kannalta.
Syövyttävissä metalleissa hajoaminen sisältää piste- ja rakokorroosiota, jännityskorroosiota ja tribologista kulumista kitkapareissa, mikä voi johtaa irtonaisiin hiukkasiin ja kudosreaktioihin. Keraamit ovat kemiallisesti vakaampia, mutta hauraita ja herkkiä halkeamia aiheuttaville virheille; siksi niiden suunnittelu vaatii virheiden tiukkaa hallintaa.
Esimerkkejä kliinisistä sovelluksista
Sydän- ja verisuonijärjestelmä. Venttiilien, siirteiden, stenttien, ekstrakorporaalisten järjestelmien ja keinotekoisten elinten materiaalien on oltava tasapainossa hemokompatibiliteetin ja mekaanisen kestävyyden sekä proteiini-/solukertymien hallinnan välillä. Ei-trombogeeniset strategiat sisältävät pinnan muokkauksia, kuten hepariinisaation ja hydrogeelipinnoitteen, sekä pintaenergian hallintaa.
Hammaslääketiede – Titaani- ja zirkoniumimplantit ovat mullistaneet proteettisen kuntoutuksen. Menestys riippuu biointegraatiosta luuhun (tarkemmin sanottuna tiiviistä tarttuvuudesta ja mekaanisesta pidättymisestä) sekä limakalvon läpäisyn tiiviyydestä. Restaurointimateriaalit (jalokeraamit, lasikeraamit) hyötyvät biokeraamien ja tarkkuuskoneistuksen kehityksestä.
Ortopedia – Lonkan ja polven endoproteesit vaativat kompromissin staattisen ja väsymislujuuden, kulutuskestävyyden ja kitkaparin (metalli–UHMWPE-polyeteeni, keraaminen–keraaminen, metalli–metalli) tribologisten ominaisuuksien välillä. Lisäksi luun ja implantin välinen yhteys on ratkaisevan tärkeä; esimerkiksi akryylisementin ja huokoisten pinnoitteiden vertailu on keskeistä osteointegraation kannalta.
Tarkkuusvalmistus, mikrorakenne ja pintatekniikka
Metallisten implanttien ominaisuudet ovat seurausta koko prosessiketjun kautta: sulattamisesta ja jalostuksesta plastisen muodonmuutoksen ja lämpökäsittelyn kautta koneistukseen, hitsaukseen, pinnoitukseen ja sterilointiin. Mikrorakenne (raekoko, faasit, tekstuuri) ja prosessin aiheuttamat viat vaikuttavat väsymislujuuteen ja korroosionkestävyyteen. Huokoisten pinnoitteiden ja rakenteiden (esim. sintratut verkot, plasmasuihkut) käyttöönotto on esimerkki monialaisesta tehtävästä: koko komponentin tarttuvuus, jäykkyys, topografia ja väsymislujuus on tasapainotettava.
Polymeereissä prosessiparametrit (lämpötila, aika ja jäännösjännitykset) ovat yhtä tärkeitä kuin antioksidanttisten stabilisaattoreiden valinta ja puhtauden valvonta, koska nämä tekijät määräävät myöhemmän biostabiilisuuden. Käytännössä on ollut tapauksia, joissa sydämentahdistimen johtimissa käytetyissä polyuretaaneissa on esiintynyt jännitysmurtumia, erityisesti jäännösjännitysten, biologisen ympäristön ja isännän aiheuttaman hapettumisen rajapinnassa.
Pintatekniikka kattaa menetelmät biomateriaalien ominaisuuksien muokkaamiseen, mukaan lukien fysikaalis-kemialliset pinnoitteet, ohutkalvot, siirrostetut polymeerikerrokset sekä mikro- ja nanotopografian hallinta. Pintaparametrien ja biologisen vasteen väliset korrelaatiot ovat erillisten käytännön luvuissa.
Pitkäaikaisesti implantoitavien laitteiden osalta pienet prosessipäätökset (esim. sterilointityyppi, varastointiaikaiset vanhentumisolosuhteet) voivat vuosia myöhemmin olla merkittäviä syitä kliinisiin eroihin; prosessihistorian ja laadunvalvonnan dokumentointi ovat olennainen osa biomateriaalien suunnittelua.
Etiikka, säännökset ja standardit
Tuotteet tuodaan markkinoille tiukkojen arviointijärjestelmien, kuten FDA:n ja ISO-standardin, mukaisesti. Turvallisuuden ja tehokkuuden osoittamisen kustannukset ovat merkittävät, mutta ne suojaavat potilaita ja muokkaavat laatupolitiikkaa. Samalla nousee esiin eettisiä kysymyksiä, kuten: miten tasapainottaa potilaiden edut ja taloudelliset paineet, miten suunnitella tutkimukset mahdollisimman pienellä riskillä, milloin ja miten vanhentuneet ratkaisut poistetaan käytöstä. Näitä kysymyksiä sekä konsensusstandardien ja teknologian kehityksen roolia käsitellään uusista tuotteista ja standardeista kertovassa osiossa. Kliininen kehitys edellyttää samanaikaista kehitystä arviointimenetelmissä, standardeissa ja etiikassa; muuten innovaatiot voivat olla illuusioita tai riskialttiita.
Näkymät
Horisontissa ovat biologisesti toimivat (ärsykkeisiin reagoivat) materiaalit ja edistyneet biosensorit ja keinotekoiset elimet (istutettavat ja ekstrakorporaaliset), jotka muuttavat biomateriaalien rajapinnan fysiologiseksi informaatiotekniikan keskukseksi. Niiden menestys riippuu pinnan vuorovaikutusten hienovaraisesta hallinnasta, pitkäaikaisesta vakaudesta ja suojautumisesta hajoamiselta. Monografian keinotekoisia elimiä ja biosensoreita käsittelevä osa osoittaa, kuinka tiiviisti materiaalit, elektroniikka ja biologia on yhdistettävä. Biomateriaalien tulevaisuus on hybridijärjestelmissä, jotka vaativat entistä tarkempaa mikrorakenteen ja pinnan hallintaa.
Biomateriaalit lääketieteessä ja hammaslääketieteessä – yhteenveto
Biomateriaalit ovat aktiivisia terapeuttisia aineita, jotka luovat biologisen mikroympäristön. Menestys riippuu yhtä lailla materiaaliluokan valinnasta, pintatekniikasta, mikrorakenteesta ja käsittelyhistoriasta kuin myös isäntäorganismien reaktioiden ja hajoamisprosessien ymmärtämisestä. Metallit, polymeerit ja keraamit tuovat mukanaan erilaisia etuja ja riskejä; luonnolliset polymeerit ja bioaktiiviset järjestelmät laajentavat palettia regeneratiivisilla toiminnoilla.
Kliinisestä näkökulmasta jokainen projekti on monitavoitteinen optimointitehtävä tietylle käyttöaiheelle ja potilasryhmälle, jonka monografia systematisoi edeten määritelmistä ja ominaisuuksista kontaktibiologian ja testauksen kautta implantoinnin ja eksplantoinnin analyysin käytännön näkökohtiin. Lopuksi, tarkkuusvalmistus ja laadunvalvonta eivät ole viimeinen vaihe, vaan olennainen osa biomateriaalitiedettä, koska ne määräävät materiaalin pitkäaikaisen käyttäytymisen kehossa.
Biomateriaalien suunnittelun yleistavoitteena on kyky yhdistää materiaalitiede, biologia ja tuotesuunnittelu – kemiasta ja mikrorakenteesta pintaan, valmistukseen ja sterilointiin. Tuloksena syntyy yksi, hyvin dokumentoitu kliininen ratkaisu, joka on vahvistettu in vitro–in vivo–kliinisessä prosessissa.
Kirjallisuus
Ratner, B.D., Hoffman, A.S., Schoen, F.J., Lemons, J.E. (toim.). Biomaterials Science: An Introduction to Materials in Medicine. Academic Press, San Diego–Lontoo–Boston–New York–Sydney–Tokio–Toronto, 1996.