Biomateriales en medicina y odontología
Índice
Los biomateriales son la columna vertebral de la medicina reconstructiva y la odontología modernas. Sus aplicaciones abarcan desde válvulas cardíacas y endoprótesis articulares hasta implantes intraóseos, sensores, electrodos y sistemas de administración de fármacos. El objetivo de este artículo es ofrecer una visión general concisa pero completa de su definición, requisitos de biocompatibilidad, clases principales, mecanismos de interacción con el organismo, ensayos y principios de degradación, así como destacar los aspectos clave de la ingeniería de superficies y la fabricación de precisión que determinan el éxito clínico de un producto. El artículo se basa en la monografía clásica Biomaterials Science: An Introduction to Materials in Medicine (Ciencia de los biomateriales: introducción a los materiales en medicina), editada por B. D. Ratner et al. (Academic Press).
Los biomateriales deben analizarse siempre en el contexto de su aplicación clínica, dentro de un entorno biológico específico y después de someterse a los procesos reales de fabricación y esterilización, ya que estas etapas definen sus propiedades funcionales y su seguridad.

¿Qué es un biomaterial y qué es la biocompatibilidad?
En la terminología adoptada en la literatura, un biomaterial es un material inanimado destinado a interactuar con un sistema biológico en un dispositivo médico. Su aceptabilidad clínica depende de la biocompatibilidad. En otras palabras, la capacidad de provocar una respuesta adecuada y deliberadamente deseada del huésped en una aplicación determinada, es decir, una que permita el efecto terapéutico previsto y no genere un riesgo inaceptable. Estas definiciones, establecidas en los trabajos de D. F. Williams y en los capítulos introductorios de monografías, entre otros, se han convertido en la piedra angular del desarrollo interdisciplinario del campo.
La biocompatibilidad es una relación material-dispositivo-paciente-aplicación; el mismo material puede ser biocompatible en un producto y problemático en otro.
Históricamente, los biomateriales han incluido tanto metales utilizados en prótesis (por ejemplo, el oro en odontología) como materiales como el vidrio o la madera en prótesis externas. La comprensión actual de la disciplina se ha desarrollado en paralelo a la cristalización de la comunidad científica, los simposios y el establecimiento de sociedades científicas. Al mismo tiempo, ha tomado forma la estructura de la literatura profesional y las normas.
La sistemática de los materiales utilizados en medicina y odontología incluye: metales, polímeros, hidrogeles, materiales biorreabsorbibles, cerámicas y vitrocerámicas, materiales naturales y compuestos, así como capas finas, recubrimientos e injertos superficiales, textiles y materiales funcionales (que responden activamente a los estímulos). Esto se resume en la parte I de la monografía, y en los capítulos detallados se analizan las características, propiedades y aplicaciones de cada clase.
En la práctica clínica, el material rara vez se presenta por sí solo. Generalmente, forma un dispositivo médico con una geometría, rugosidad, pureza e historial de procesamiento específicos. Por ejemplo, los capítulos de las partes II y VII describen implantes vasculares, electrodos, sensores, implantes dentales y ortopédicos y sistemas de administración de fármacos.
Los metales (por ejemplo, aceros Cr-Ni-Mo, aleaciones Co-Cr y aleaciones de titanio) siguen siendo la base de los implantes sometidos a cargas mecánicas (placas, tornillos, endoprótesis, componentes de válvulas, etc.). Las propiedades mecánicas, la vida útil y la resistencia a la corrosión son fundamentales, y su nivel depende en gran medida del historial de procesamiento (desde la fundición hasta el trabajo plástico y el tratamiento térmico) y la microestructura.
Los polímeros (desde termoplásticos hasta elastómeros y resinas reticuladas) proporcionan flexibilidad, baja densidad, facilidad de conformado y la capacidad de modificar la microestructura y la función (por ejemplo, en recubrimientos hemocompatibles, geles conductores o membranas). Los capítulos sobre polímeros hacen hincapié en la importancia del peso molecular (Mn, Mw), la polidispersidad y la táctica para las propiedades mecánicas y de procesamiento. Desde un punto de vista operativo, la transición vítrea (Tg), la fusión cristalina (Tm) y la meseta del caucho, visibles en las pruebas DMA, son fundamentales.
La cerámica y la vitrocerámica, que van desde óxidos (como la alúmina y la zirconia) hasta vidrios bioactivos, son cruciales en aplicaciones en las que se requiere una alta dureza, estabilidad química y bioactividad. Por ejemplo, en odontología restauradora y reparación de defectos óseos. Estos materiales pueden formar una unión fuerte y mediada químicamente con el tejido (bioactividad), lo que se analiza en detalle en la clase «biocerámica».
Los materiales naturales (colágeno, elastina, polisacáridos, etc.) están ganando importancia en la ingeniería de tejidos debido a su similitud con la matriz extracelular y su potencial para promover la regeneración (por ejemplo, andamios cutáneos o nerviosos).
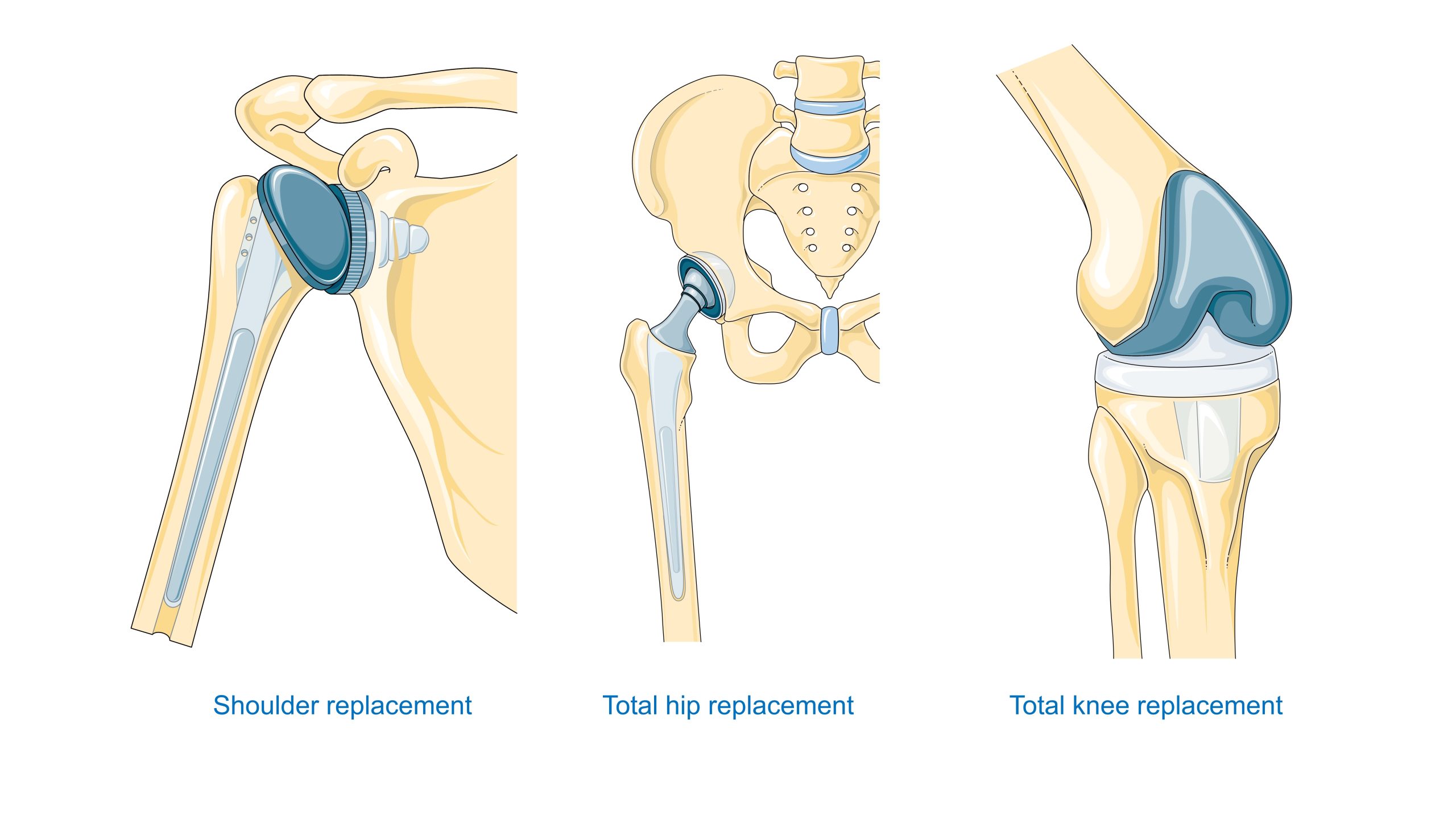
La elección del material está relacionada con la ubicación anatómica y el régimen de tensión: las válvulas cardíacas requieren resistencia a la fatiga y a la coagulación sanguínea; las endoprótesis de cadera requieren una alta resistencia y pares de fricción adecuados y los implantes dentales requieren biointegración y estanqueidad biológica del paso de los tejidos blandos. El capítulo VII ofrece descripciones detalladas de estos requisitos para tipos específicos de productos.
Propiedades de volumen y superficie
En los biomateriales, distinguimos entre propiedades de volumen (resistencia, módulo, resistencia al impacto, fluencia, fatiga y conductividad) y propiedades de superficie (energía y química de la superficie, carga, topografía y capa límite tras la adsorción de proteínas). Estas últimas determinan el primer contacto con la sangre y los tejidos: la cascada de adsorción de proteínas, la activación celular y la cascada de coagulación. La monografía incluye capítulos dedicados a la adsorción de proteínas y la respuesta de la sangre al material, así como a las correlaciones entre las propiedades superficiales y la respuesta biológica.
En los polímeros, la arquitectura de las macromoléculas (lineales, ramificadas o reticuladas), la cristalinidad, la táctica y la distribución del peso molecular determinan las respuestas mecánicas y térmicas. Desde una perspectiva de ingeniería, los parámetros que controlan el procesamiento (por ejemplo, inyección, extrusión o moldeo reactivo) y el comportamiento durante el ciclo de vida del producto son fundamentales. Las distribuciones de Mn/Mw, Tg y Tm, así como los espectros DMA, sirven de base para diseñar estructuras de membranas, recubrimientos y elastómeros implantables.
Incluso diferencias sutiles en las propiedades de la superficie (química, nanotextura, historial de esterilización, etc.) pueden alterar radicalmente el perfil de adsorción de proteínas y, posteriormente, afectar a la trombogenicidad y la cicatrización. Por esta razón, gestionar el estado de la superficie es tan importante como seleccionar la composición química del material.
¿Cómo responde el cuerpo al biomaterial?
Tras la implantación, se desencadena una cadena de reacciones del huésped que incluyen hemostasia, inflamación aguda, proliferación y remodelación tisular en presencia de un cuerpo extraño. Esto da lugar a una reacción a cuerpos extraños caracterizada por la activación crónica de los macrófagos, la formación de células gigantes de cuerpos extraños y el desarrollo de una cápsula fibrosa. Otros procesos complejos implican el contacto con la sangre (activación plaquetaria y cascada de coagulación) y el sistema inmunitario (inmunología y sistema del complemento). El compendio de los capítulos 4.1-4.7 proporciona un marco conceptual y métodos para evaluar esta respuesta.
El patrón de respuesta depende del lugar de implantación, el tamaño y la rugosidad, así como de la composición del material y el estado de la superficie. De hecho, incluso el mismo material puede inducir diferentes fenotipos de macrófagos en el tejido blando y el tejido perióstico. Por lo tanto, la evaluación de la biocompatibilidad debe ser específica para cada aplicación (in vitro + in vivo).
hemocompatibilidad), estudios in vivo (modelos animales y lugares de implantación), pruebas sangre-material y el diseño de modelos animales adaptados a la indicación clínica. Las directrices recopiladas en las secciones 5.1-5.5 establecen un lenguaje común para los laboratorios académicos e industriales, así como para la evaluación reglamentaria. Los resultados de un nivel (por ejemplo, in vitro) no pueden extrapolarse directamente a los resultados clínicos; la triangulación de datos (análisis in vitro-in vivo-explante) es el estándar de referencia en el desarrollo y la supervisión de productos.
Degradación y envejecimiento en un entorno biológico
El cuerpo no es un entorno sencillo para el diseño de materiales. Es rico en proteínas, enzimas y células capaces de generar especies reactivas de oxígeno y cloro. En este entorno, los materiales están sujetos a hidrólisis, oxidación, corrosión, fatiga, agrietamiento por tensión e incluso mineralización patológica. Las secciones 6.1-6.5 ofrecen una visión general transversal de los mecanismos de degradación de los polímeros, los metales y las cerámicas.
Es especialmente instructivo el mecanismo por el cual el polímero huésped se oxida. En la inflamación aguda, los neutrófilos producen aniones superóxido, peróxido de hidrógeno y (con la participación de la mieloperoxidasa) ácido hipocloroso (HOCl); los macrófagos, que predominan de forma crónica (junto con las células gigantes), mantienen la emisión de radicales libres y la adhesión de la MPO a la superficie del cuerpo extraño puede proporcionar un catalizador en el lugar de la implantación. Este entorno favorece la oxidación de los enlaces éter y uretano, así como la aparición de grietas y agrietamiento por tensión en los elastómeros de uretano, fenómenos observados, entre otros, en los componentes de poliuretano de los electrodos y los cables de los marcapasos.
La degradación es sinérgica: las cargas alternas producen microfisuras y una superficie nueva y reactiva; la absorción de agua altera el pH local y facilita la difusión de reactivos y los productos de hidrólisis aumentan la hidrofilia y la penetración de los agentes de degradación. El control de la composición, la estabilización antioxidante y las condiciones de tensión residual son fundamentales para la seguridad a largo plazo.
En los metales corrosivos, la degradación incluye la corrosión por picaduras y por hendiduras, la corrosión por tensión y el desgaste tribológico en pares de fricción. Esto puede provocar que aparezcan partículas sueltas y reacciones tisulares. Las cerámicas, aunque químicamente más estables, son frágiles y sensibles a los defectos que provocan grietas; por lo tanto, su diseño requiere un control riguroso de los defectos.
Ejemplos de aplicaciones clínicas
Sistema cardiovascular: los materiales para válvulas, injertos, stents, sistemas extracorpóreos y órganos artificiales deben lograr un equilibrio entre la hemocompatibilidad y la durabilidad mecánica, así como la resistencia al depósito de proteínas y células. Las estrategias no trombogénicas incluyen modificaciones de la superficie (como la heparinización y los hidrogeles) y el control de la energía superficial.
Odontología: los implantes de titanio y circonio han revolucionado la rehabilitación protésica. El éxito depende de la biointegración con el hueso (más precisamente, la adhesión estrecha y la retención mecánica) y la hermeticidad del paso a través de la membrana mucosa. Los materiales para restauraciones (cerámicas preciosas y vitrocerámicas) se benefician de los avances en biocerámica y mecanizado de precisión.
Ortopedia: las endoprótesis de cadera y rodilla requieren un compromiso entre la resistencia estática y a la fatiga, la resistencia al desgaste y las propiedades tribológicas del par de fricción (metal-polietileno UHMWPE, cerámica-cerámica o metal-metal). Además, la conexión con el hueso es crucial: se compara el cemento acrílico con los recubrimientos porosos para la osteointegración.
Fabricación de precisión, microestructura e ingeniería de superficies
En el caso de los implantes metálicos, las propiedades son el resultado de toda la cadena de procesamiento, desde la fundición y el refinado, pasando por la deformación plástica y el tratamiento térmico, hasta el mecanizado, la soldadura, el recubrimiento y la esterilización. La microestructura (tamaño del grano, fases, textura, etc.) y los defectos inducidos por el proceso influyen en la resistencia a la fatiga y la resistencia a la corrosión. La introducción de recubrimientos y estructuras porosas (por ejemplo, mallas sinterizadas o pulverizaciones de plasma) es un ejemplo de tarea interdisciplinaria: se debe equilibrar la adhesión, la rigidez, la topografía y la integridad a la fatiga de todo el componente.
En los polímeros, los parámetros de procesamiento (temperatura, tiempo y tensiones residuales) son igualmente importantes, al igual que la selección de estabilizadores antioxidantes y el control de la pureza, ya que estos factores determinan la bioestabilidad posterior. En la práctica, se han dado casos de agrietamiento por tensión en poliuretanos utilizados en cables de marcapasos, concretamente, en la interfaz entre las tensiones residuales, el entorno biológico y la oxidación por parte del huésped.
La ingeniería de superficies es un conjunto de herramientas para modificar propiedades que van desde recubrimientos fisicoquímicos hasta la aplicación de películas finas y capas de polímeros injertados, así como micro/nanotopografía. Las correlaciones entre los parámetros de la superficie y la respuesta biológica son objeto de capítulos prácticos específicos.
En el caso de los dispositivos implantados a largo plazo, las pequeñas decisiones sobre el proceso (por ejemplo, el tipo de esterilización o las condiciones de almacenamiento y envejecimiento) pueden convertirse en causas importantes de diferencias clínicas años más tarde. Así pues, la documentación del historial de procesamiento y el control de calidad son partes integrantes del diseño de biomateriales.
Ética, normativas y estándares
Los productos se comercializan bajo rigurosos sistemas de evaluación, como los de la FDA y la ISO. El coste de demostrar la seguridad y la eficacia es significativo, pero protege a los pacientes y da forma a la política de calidad. Al mismo tiempo, surgen cuestiones éticas: cómo equilibrar los intereses de los pacientes y las presiones económicas, cómo diseñar estudios con un riesgo mínimo, cuándo y cómo retirar las soluciones obsoletas. Estas cuestiones, junto con el papel de las normas consensuadas y el desarrollo tecnológico, se tratan en la sección sobre nuevos productos y normas. El progreso clínico requiere un avance simultáneo en la metodología de evaluación, las normas y la ética; de lo contrario, la innovación puede ser ilusoria o arriesgada.
Perspectivas
En el horizonte se vislumbran materiales biológicamente funcionales (que responden a estímulos) y sistemas avanzados de biosensores y órganos artificiales (implantables y extracorpóreos) que convierten la interfaz biomaterial en el centro de la informática fisiológica. Su éxito dependerá del control sutil de las interacciones superficiales, la estabilidad a largo plazo y la protección contra la degradación. La sección de la monografía dedicada a los órganos artificiales y los biosensores muestra lo estrechamente que deben colaborar los materiales, la electrónica y la biología. El futuro de los biomateriales reside en los sistemas híbridos que requerirán un control aún más meticuloso de la microestructura y la superficie.
Biomateriales en medicina y odontología: resumen
Los biomateriales son componentes activos de la terapia que cocrean el microambiente biológico. El éxito viene determinado por igual por la elección de la clase de material, la ingeniería de superficies, la microestructura y el historial de procesamiento, así como por la comprensión de la respuesta del huésped y los mecanismos de degradación a lo largo del tiempo. Los metales, los polímeros y las cerámicas aportan diferentes ventajas y riesgos; los polímeros naturales y los sistemas bioactivos amplían la paleta con funciones regenerativas.
Desde una perspectiva clínica, cada proyecto presenta un problema de optimización multiobjetivo para una indicación y una población de pacientes específicas que la monografía sistematiza pasando por las definiciones y propiedades, a través de la biología de contacto y las pruebas, hasta los aspectos prácticos de la implantación y el análisis de la explantación. Por último, la fabricación de precisión y el control de calidad no son la última etapa, sino una parte integral de la ciencia de los biomateriales, ya que dictan el comportamiento a largo plazo del material en el cuerpo.
La competencia general en el diseño de biomateriales es la capacidad de combinar la ciencia de los materiales con la biología y la ingeniería de productos, desde la química y la microestructura, pasando por la superficie, hasta la fabricación y la esterilización. El resultado es una solución clínica única y bien documentada, verificada en la vía in vitro-in vivo-clínica.
Bibliografía
Ratner, B. D., Hoffman, A. S., Schoen, F. J., Lemons, J. E. (eds.). Biomaterials Science: An Introduction to Materials in Medicine. Academic Press, San Diego–Londres–Boston–Nueva York–Sídney–Tokio–Toronto, 1996.